
【题目】向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图,则下列离子组在对应的溶液中一定能大量共存的是
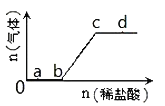
A.a点对应的溶液中:Ca2+、Mg2+、Br-、NO3-
B.b点对应的溶液中:Al3+、Fe3+、MnO4-、NO3-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
科目:高中化学 来源: 题型:
【题目】在常温下,有下列五种溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4
④0.1mol/LNH4HCO3 ⑤0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液①呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(2)溶液⑤呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(3)比较溶液①、③中c(NH4+)的大小关系是① ______ ③(填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则CH3COO-的水解程度 ______ NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2mol·L1
C.该反应的化学平衡常数可表示为![]()
D.升高温度,达到平衡状态时 Ⅰ中c(O2)<0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物性质描述正确的是
A. 在Na2O2中阳离子与阴离子的个数比为2:1
B. 只有钠单质和钠盐的焰色反应呈现黄色
C. 可用石灰水区分Na2CO3与NaHCO3溶液
D. 氢氧化钠溶液具有碱性,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.电解CuCl2溶液:CuCl2=Cu2++2Cl-
B.Mg和Cl形成离子键的过程:![]()
C.向Al2(SO4)3溶液中滴加Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
D.乙酸与乙醇发生酯化反应:CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,M为铁棒,N为石墨棒。关于此装置的下列叙述中,不正确的是( )
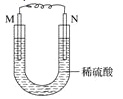
A.M为负极,N为正极
B.N上发生的反应为2H++2e=H2↑
C.M上发生的反应为Fe-3e-=Fe3+
D.溶液中的硫酸根离子向M移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向下列装置中缓慢通入气体X,分别进行关闭和打开活塞K的操作,则品红溶液和澄清石灰水中现象相同的一组是
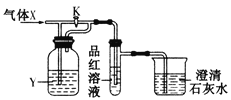
选项 | A | B | C | D |
X | NO2 | SO2 | Cl2 | CO2 |
Y(过量) | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe2O3
Fe2O3
B.NH4HCO3(s)![]() NH3(g)
NH3(g)![]() NO2(g)
NO2(g)
C.S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D.NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
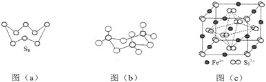
回答下列问题:
(1)基态S原子电子占据最高能级的电子云轮廓图为__________形。
(2)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为__________形,其中共价键的类型有__________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________。
(4)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g/cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为__________nm。
所形成的正八面体的体心,该正八面体的边长为__________nm。
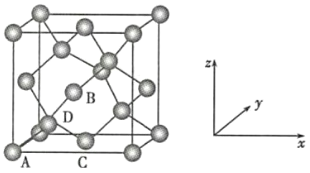
晶胞有两个基本要素:
(6)晶胞的一个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__________。
,0)。则D原子的坐标参数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com