
【题目】某重要有机合成中间体X的结构如图所示,有关该物质的说法不正确的是
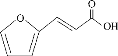
A.X与庚二酸(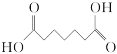 )互为同分异构体
)互为同分异构体
B.X可以使溴水、酸性KMnO4褪色,且原理不相同
C.标准状况下1molX分别和足量Na和NaHCO3反应,生成气体体积不相同
D.X分子中所有碳原子可能共面
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验探究反应速率的测定和比较。
[实验步骤]
Ⅰ.取一套装置(装置如下图所示),加入40mL1mol/L的硫酸,测量收集10mLH2所需的时间。
Ⅱ.取另一套装置,加入40mL1mol/L的硫酸,测量收集10mLH2所需的时间。
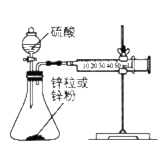
(1)[实验现象]
锌跟硫酸反应产生气泡,收集10mL气体, Ⅱ所用时间比Ⅰ所用时间_____。
(2)[实验结论]
4mol/L硫酸与锌反应比1mol/L硫酸与锌反应速率____。
(3)[注意事项]
a.锌粒的颗粒(即表面积)大小_____;
b.40mL硫酸要迅速加入;
c.装置____,且计时要迅速、准确;
d.气体收集可以用排水量气装置代替。
(4)实验讨论]除本实验测定反应速率的方法外,可行的方案还有(填两条):
a.________;b._______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铁表面镀铜时,将铁与电源的正极相连,铜与电源的负极相连
B. 0.01 mol Cl2通入足量水中,转移电子的数目为6.02×1021
C. 反应3C(s)+CaO(s)===CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的ΔH>0
D. 加水稀释0.1 mol·L-1CH3COOH溶液,溶液中所有离子的浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成(部分反应物或产物省略,另请注意箭头的指向方向):
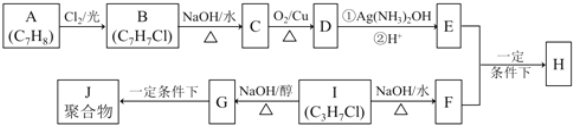
已知以下信息:
i.A属于芳香烃,H属于酯类化合物
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1
回答下列问题:
(1) D的含氧官能团名称_________,B的结构简式_________
(2) B![]() C和G
C和G![]() J两步的反应类型________、_________
J两步的反应类型________、_________
(3)E+F![]() H的化学方程式______________
H的化学方程式______________
(4)I![]() G 的化学方程式_______________
G 的化学方程式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用燃料,减小污染符合 “绿色化学”理念,下列关于燃料的说法中正确的是( )
A.“可燃冰”是将水变为油的新型燃料
B.通入大大过量的空气使燃料充分燃烧,从而达到充分利用热能的目的
C.燃料的化学能可以在不同的条件下转化为热能、电能被人类利用
D.硫的燃烧热为akJ·mol-1,硫燃烧的热化学方程式为S(s)+![]() O2(g)=SO3(g) △H=-akJ·mol-1
O2(g)=SO3(g) △H=-akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应N2(g)+3H2(g) ![]() 2NH3(g);ΔH<0的图示与对应的叙述相符合的是( )
2NH3(g);ΔH<0的图示与对应的叙述相符合的是( )
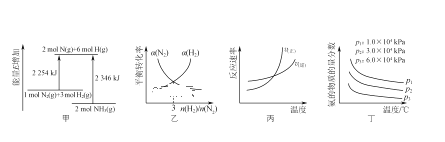
A.由图甲可知N2(g)+3H2(g) ![]() 2NH3(g);ΔH=-92 kJ·mol-1
2NH3(g);ΔH=-92 kJ·mol-1
B.图乙表示达到平衡时N2、H2的转化率(α)随n(H2)/n(N2)比值的变化
C.图丙表示正、逆反应速率随温度的变化
D.图丁表示反应达平衡时,混合气体中氨的物质的量分数随温度、压强的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是有机生产中重要的生产原料,利用氯苯可合成![]() ,其工艺流程如下
,其工艺流程如下![]() 部分试剂和反应条件已略去
部分试剂和反应条件已略去![]() :
:
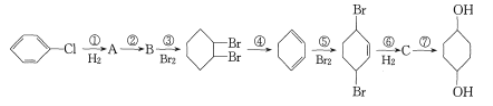
回答下列问题:
(1)B分子中含有的官能团名称为________。
(2)反应③~⑦中属于消去反应的是________![]() 填序号
填序号![]() 。
。
(3)反应④和⑦的化学方程式分别为_______________________________________。
(4)结合上述流程,写出以![]() 为原料制备
为原料制备![]() 的合成路线图,合成路线流程图示例如下:______
的合成路线图,合成路线流程图示例如下:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应来生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
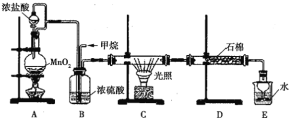
(1)A中制取Cl2的反应的化学方程式是________________________。
(2)B装置的作用:①;________;②________;③________。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________________________。
(4)E装置的作用有________(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为____mol·L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是____。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O和NO+NO2+2OH-=____+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为____。
②Cu与Cu2O的物质的量之比为____。
③HNO3的物质的量浓度为____mol·L-1。
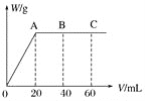
(4)有H2SO4和HNO3的混合溶液20mL,加入0.25molL-1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为____mol·L-1,HNO3的物质的量浓度为____mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com