
【题目】在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为______(填化学式),V4+﹣O﹣H在反应过程中作___________。当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为____________L。

(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣538kJ·mol﹣1。断开1mol下列化学键系数的能量分别为N﹣H:390kJ、N≡N:946kJ、O﹣H:460kJ、O=O:498kJ。则断开1molN﹣N需要吸收的能量是__________.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①若其它条件不变,则下列图象不正确的是_____(填字母)。
A. B.
B.  C.
C. D.
D.
②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示。
| c(NH3)/mol·L﹣1 | c(O2)/mol·L﹣1 | c(NO)mol·L﹣1 |
0 | 1.2 | 1.75 | 0 |
4min | 0.4 | 0.75 | 0.8 |
6min | 0.4 | 0.75 | 0.8 |
8min | 0.6 | 1 | 0.6 |
9min | 0.6 | 1 | 0.6 |
10min | 1.05 | 1 | 1.05 |
12min | … | … | … |
0~4min内,用O2表示该反应的平均反应速率为______mol·L﹣1·min﹣1。反应6~8min时改变了反应条件,改变的反应条件可能是___________。
【答案】N2 催化剂 44.8 190kJ D 0.25 升高温度
【解析】
本题考查化学平衡的计算;有关反应热的计算;化学平衡的影响因素.氧化还原反应中得失电子总数相等;反应热=反应物总键能﹣生成物总键能;分析化学平衡影响因素时,要分析反应特点即:反应热、方程式两边气体体积变化情况;反应速率等于单位时间内的浓度变化。
(1)由图1可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;V4+﹣O﹣H在反应前后不变,作催化剂;氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.5mol O2得到2mol电子,则NO转化为N2得到的电子为4mol,所以NO的物质的量为2mol,其体积为44.8L;
故答案为:N2;催化剂;44.8;
(2)焓变=反应物总键能﹣生成物总键能,设断开1molN﹣N需要吸收的能量QkJ,则:Q+4×390+498﹣946﹣4×460=﹣538,解得Q=190;
故答案为:190kJ;
(3)①该反应是气体体积增大、正反应放热的反应,
A、增大压强,反应逆向移动,氨气的转化率减小,且压强增大化学反应速率增大,缩短反应到达平衡的时间,所以图象符合,故A不选;
B、催化剂加快反应速率,但不改变平衡,所以图象符合,故B不选;
C、增大压强,逆向移动,NO的产率降低,所以图象符合,故C不选;
D、升高温度,反应逆向移动,水蒸气的含量降低,所以图象不符合,故D选;
故答案为:D;
②0~4min内,v(O2)=![]() mol/(L.min)=0.25mol/(L.min);反应6~8min时反应逆向移动,可能为升高温度,
mol/(L.min)=0.25mol/(L.min);反应6~8min时反应逆向移动,可能为升高温度,
故答案为:0.25;升高温度.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器A中发生反应的化学方程式为____________。
(2)装置B中的试剂是____________,若撤去装置B,可能导致装置D中副产物____________(填化学式)的量增加;装置D可采用____________加热的方法以控制反应温度在70℃左右。
(3)装置中球形冷凝管的作用为____________,写出E中所有可能发生的无机反应的离子方程式____________。
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行____________。
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000molL-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O溶液20.00mL。则产品的纯度为____________(计算结果保留三位有效数字)。
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是____________
a.分别测定0.1molL-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1molL-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3mol/LB.Y2为0.45mol/L
C.X2为0.2mol/LD.Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体![]() 是无公害型冷却水系统的金属缓蚀剂,由钼精矿
是无公害型冷却水系统的金属缓蚀剂,由钼精矿![]() 主要成分是
主要成分是![]() ,含少量PbS等
,含少量PbS等![]() 制备钼酸钠晶体的部分流程如图所示
制备钼酸钠晶体的部分流程如图所示
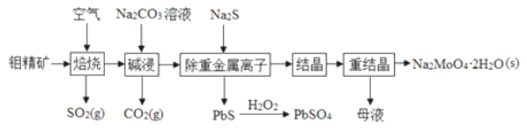
![]() 中钼元素的化合价为__________。
中钼元素的化合价为__________。
![]() 焙烧时为了使钼精矿充分反应,可采取的措施是__________
焙烧时为了使钼精矿充分反应,可采取的措施是__________![]() 答出一条即可
答出一条即可![]() 。
。
![]() 焙烧过程中钼精矿发生的主要反应的化学方程式为
焙烧过程中钼精矿发生的主要反应的化学方程式为![]() 未配平
未配平![]() ,该反应中氧化产物是__________
,该反应中氧化产物是__________![]() 填化学式
填化学式![]() ;当生成
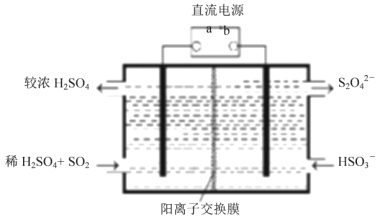
;当生成![]() 时,该反应转移的电子的物质的量为__________mol。利用下图所示装置
时,该反应转移的电子的物质的量为__________mol。利用下图所示装置![]() 电极均为惰性电极
电极均为惰性电极![]() 也可吸收
也可吸收![]() ,并用阴极排出的溶液吸收
,并用阴极排出的溶液吸收![]() 。阳极的电极反应式为__________,在碱性条件下,用阴极排出的溶液吸收
。阳极的电极反应式为__________,在碱性条件下,用阴极排出的溶液吸收![]() ,使其转化为无害气体,同时有
,使其转化为无害气体,同时有![]() 生成,该反应的离子方程式为______。
生成,该反应的离子方程式为______。
![]() 碱浸时,
碱浸时,![]() 与
与![]() 溶液反应的离子方程式为___________。
溶液反应的离子方程式为___________。
![]() 重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______。
重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______。
![]() 过滤后的碱浸液结晶前需加入
过滤后的碱浸液结晶前需加入![]() 固体以除去
固体以除去![]() ,当
,当![]() 开始沉淀时,
开始沉淀时, ![]() 去除率为
去除率为![]() ,已知碱浸液中
,已知碱浸液中![]() ,
,![]() ,
,![]() 、则
、则![]() ___________
___________![]() 加入
加入![]() 固体引起的溶液体积变化可忽略
固体引起的溶液体积变化可忽略![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2 L的密闭容器中,加入0.8 mol的H2和0.6 mol 的I2,在一定的条件下发生如下反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0反应中各物质的浓度随时间变化情况如图:
2HI(g) ΔH<0反应中各物质的浓度随时间变化情况如图:
(1)根据如图数据,反应开始至达到平衡时,平均速率v(HI)为________。
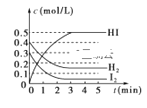
(2)反应达到平衡后,第8 min时:①若升高温度,化学平衡常数K________(填“增大”、“减小”或“不变”),HI浓度的变化正确的是________(用如图中a~c的编号回答)。
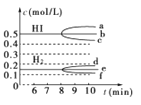
②若加入I2,H2浓度的变化正确的是________(用如图中d~f的编号回答)。
(3)反应达到平衡后,第8 min时,若反应容器的容积扩大一倍,请在图中画出8 min后HI浓度的变化情况。
 ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2-
C.FeCl3溶液:K+、Na+、Fe2+、S2-
D.![]() =0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com