
| A. | 在FeSO4溶液中滴入KSCN溶液,溶液显红色 | |
| B. | 铁位于元素周期表中第4周期第Ⅷ族 | |
| C. | 在化合物中,铁通常呈现为+2,+3价 | |
| D. | 通常情况下,铁丝在氯气里燃烧时生成FeCl3 |
分析 A、溶液中滴入KSCN溶液,溶液显红色证明含有铁离子;
B、铁是26号元素,有四个电子层,最外层为2个电子;
C、铁元素常见化合价为+2,+3价;
D、氯气具有强氧化性,铁和氯气反应生成氯化铁.
解答 解:A、溶液中滴入KSCN溶液,溶液显红色证明含有铁离子,亚铁离子和KSCN溶液不反应,故A错误;
B、铁是26号元素,有四个电子层,最外层为2个电子,位于第四周期第Ⅲ族,故B正确;
C、依据原子结构分析可知,铁元素常见化合价为+2,+3价,故C正确;
D、氯气具有强氧化性,铁和氯气反应生成氯化铁,与铁的用量无关,故D正确;
故选A.
点评 本题考查了铁的原子结构,性质分析,掌握基础是解题关键,注意氯气的强氧化性氧化铁为三价化合物,题目较简单.


科目:高中化学 来源: 题型:选择题
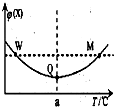 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )| A. | M 点时,Y 的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入 Z 达到新平衡时 Z 的体积分数增大 | |
| D. | W,M 两点 Y 的正反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图所示.
A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (H+)>10-7 mol/L>c (OH-) pH<7 显中性 | |
| B. | c (H+)=c (OH-)>10-7 mol/L pH<7 显中性 | |
| C. | c (H+)>10-7 mol/L>c (OH-) pH<7 显酸性 | |
| D. | c (H+)=c (OH-)>10-7 mol/L pH=7 显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | 只有④ | C. | ③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | CuSO4 | C. | HCl | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1 mol Fe与足量稀HNO3反应,转移电子数目一定为为3NA | |
| B. | 0.1 mol/L NaHCO3溶液中含有Na+数目为0.1NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 常温下,1 mol Fe与足量浓硫酸反应,转移电子数目一定为为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com