
原子序数大于4小于18的主族元素X和Y,已知它们的离子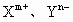 的核外电子排布相同,则X和Y的核电荷数之差为________(用含m、n的代数式表示),微粒的半径
的核外电子排布相同,则X和Y的核电荷数之差为________(用含m、n的代数式表示),微粒的半径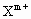 ________
________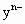 (填“大于”、“小于”、“等于”).
(填“大于”、“小于”、“等于”).
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:阅读理解
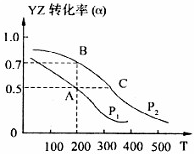 (2011?德州二模)短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是自然界含量最多的元素,从是同周期中金属性最强的元素,M的负一价离子与Z的某种氢化物分子含有相同的电子数.
(2011?德州二模)短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是自然界含量最多的元素,从是同周期中金属性最强的元素,M的负一价离子与Z的某种氢化物分子含有相同的电子数.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
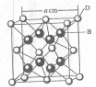 (2011?咸阳模拟)[化学-选修物质结构与性质]
(2011?咸阳模拟)[化学-选修物质结构与性质]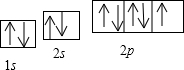

| ||
| a3cm3 |
| ||
| a3cm3 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com