
分析 方案一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
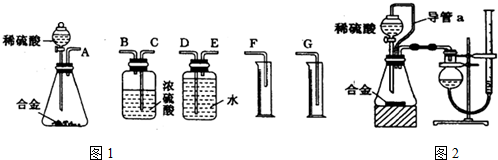
方案二:(1)装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部;
(2)①保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积(注意应保持干燥管与滴定管内液面等高),收集氢气后滴定管内液面上升,读数减小;
③气体受温度和压强的影响较大,若要确定气体的物质的量,必须知道实验时的温度和压强.
解答 解:方案一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为3%时,金属铝的含量最高,10.8g合金中铝的质量为,10.8g×(1-3%)=10.8×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
10.8g×97% V×10-3L×4.0mol/L
所以54g:(10.8g×97%)=2mol:(V×10-3L×4.0mol/L),解得:V=97,
故V(NaOH溶液)≥97mL,
故答案为:97;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,
故答案为:偏高;
方案二:(1)装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G),
故答案为:E、D、G;
(2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差,
故答案为:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积,收集氢气后滴定管内液面读数减小,所以测定氢气的体积为V1-V2,
故答案为:V1-V2,
③由于气体受温度和压强的影响较大,若要确定气体的物质的量,必须知道实验时的温度和压强,
故答案为:实验时的温度和压强.
点评 本题主要考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,题目难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入3mol H2和1molN2,充分反应后可得到NH3分子数为2NA | |
| B. | 0.1mol/L Na2SO4溶液中含有Na+为0.2NA | |
| C. | 一定条件下,23 g Na与O2反应生成Na2O2时失去的电子数为NA | |
| D. | 标准状况下,22.4L SO3中含有的氯原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、甲苯 | B. | 乙炔、苯乙烯 | C. | 甲醛、甲酸甲酯 | D. | 甲烷、辛醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有 18 个族 | |
| B. | 1-20 号元素称为短周期元素 | |
| C. | 元素周期表中有 7 个主族,7 个副族 | |
| D. | 零族元素原子最外层均为 8 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠溶液存在下加热水解后,加入硝酸银溶液 | 可用于检验溴元素的存在 |
| B | 苯中有少量苯酚,加入氢氧化钠溶液后,分液 | 可用于除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可用于除去乙烷中的乙烯 |
| D | 测乙烯与溴水反应前后的pH | 可验证发生的是加成反应还是取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com