
【题目】按要求作答:
(1)常温下,pH=2的醋酸和pH=12的氢氧化钠等体积混合,混合后溶液呈_____性
(2)25℃时,柠檬水的pH是3,其中氢氧根离子浓度是_______mol/L
(3)已知下列反应:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1= -akJ/mol
②C(s)+O2(g)=CO2(g) △H2= -bkJ/mol
则反应2C(s)+2H2O(l) =CH3COOH(l)的反应热为△H=_____________kJ/mol
【答案】酸 1×10-11 a-2b
【解析】
(1)pH=2的醋酸,其浓度大于0.01mol/L,pH=12的氢氧化钠,其浓度等于0.01mol/L,等体积混合后,醋酸过量;
(2)根据溶液pH计算c(H+),利用室温下水的离子积常数Kw=10-14计算溶液中c(OH-);
(3)根据盖斯定律,将已知的热化学方程式叠加,可得反应2C(s)+2H2O(l) =CH3COOH(l)的反应热。
(1)pH=2的醋酸,其浓度大于0.01mol/L,pH=12的氢氧化钠,其浓度等于0.01mol/L,等体积混合后,电离的醋酸与NaOH恰好反应,但由于醋酸过量,反应后溶液为醋酸和醋酸钠的混合溶液,则溶液显酸性;
(2) 25℃时,柠檬水的pH是3,c(H+)=10-3mol/L,由于室温下水的离子积常数Kw=10-14,所以其中氢氧根离子浓度c(OH-)=![]() mol/L=10-11mol/L;
mol/L=10-11mol/L;
(3)由于反应放出或吸收的热量与反应过程无关,而与物质的始态和终态有关,①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1= -akJ/mol;②C(s)+O2(g)=CO2(g) △H2= -bkJ/mol;根据盖斯定律,2×②-①,整理可得2C(s)+2H2O(l) =CH3COOH(l) △H= (a-2b) kJ/mol。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
【题目】综合处理工业“三废”,有利于保护环境、节约资源。反应 2NO(g)+2CO(g)2CO2(g)+N2(g),可减少汽车尾气中污染物的排放,在 2L 密闭容器中发生该反应时,n(CO2)随温度 T 和时间 t 的变化曲线如图所示。
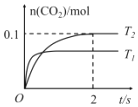
(1)该反应的平衡常数表达式为K=______,若升高温度,平衡常数 K 值______(填“增加”“减小”或“不变”),说明理由______;
(2)在 T2温度下, 0~2s 内的平均反应速率 v(N2)=______;
(3)工业废水的处理方法有很多,使用 Fe2(SO4)3 处理废水,酸性废水中的悬浮物很难沉降除去,结合离子方程式用平衡移动原理解释原因______,干法制备多功能水处理剂高铁酸钠(Na2FeO4)的反应原理为:2FeSO4+6Na2O2→2Na2FeO4+Na2O+2Na2SO4+O2↑,该反应的氧化剂为______;
(4)采用氨碱法生产纯碱会产生大量的副产品______,用化学方程式表示产生副产品的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是两根石墨棒。下列叙述正确的是( )
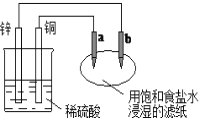
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.A物质与C物质的反应速率之比为1∶2
B.单位时间内消耗a mol A,同时消耗3a mol C
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列热化学反应方程式:
(1)1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量:______________。
(2)1molN2(g)与适量O2(g)起反应生成NO(g),吸收68kJ热量:_______________。
(3)1molCu(s)能与一定量的O2(g)起反应生成CuO(s),放出157kJ热量:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含5.00×10-3 mol·L-1的Cr2O![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:

(1)第①步反应的离子方程式是__________________________________________
(2)第②步中用pH试纸测定溶液pH的操作是______________________________
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为______________,加碱调节至pH为________时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是______________________,原因是________________________________________________。
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br-
B.SO42-
C.H2SO3
D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(CO)=1.5mol·L-1·min-1B.v(NO2)=0.8mol·L-1·min-1
C.v(N2)=0.3mol·L-1·min-1D.v(CO2)=1.1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )

A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com