
(1)分子中有42个电子的烷烃的名称可能是_________________。
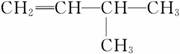 (2)有机物 的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是______________。
(2)有机物 的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是______________。
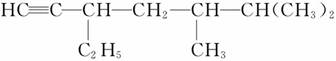 (3)有机物 的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________________。
(3)有机物 的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________________。
科目:高中化学 来源: 题型:
I.将一定量NO2和N2O4的混合气体通入体积为1L 的恒温密闭容器中,各物
的恒温密闭容器中,各物
质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
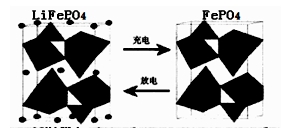
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-, 且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是 ( )
2Z(g)一定达到化学平衡状态的是 ( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成nmol Z,同时生成2nmol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图甲、乙是电化学实验装置。
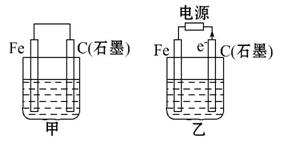
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为 ;
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200 mL pH = 5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
查看答案和解析>>
科目:高中化学 来源: 题型:
航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式如下:N2H4+2H2O2====N2↑+4H2O。下列说法中错误的是 ( )
A.该反应中肼作还原剂
B.此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ
C.肼(N2H4)分子中只存在极性共价键
D.该反应的反应物总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的金属铁与下列酸溶液反应,初始反应速率最快且最终产生氢气最多的是 ( )
A.100 mL 0.1 mol·L-1盐酸
B.75 mL 0.2 mol·L-1盐酸
C.100 mL 0.2 mol·L-1硝酸
D.20 mL 18.4 mol·L-1硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是 ( )
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com