
| A. | 2-甲基-3-丁烯 | B. | 4-甲基-3-乙基已烷 | ||
| C. | 4-甲基-3-戊醇 | D. | 2,3,3-三甲基戊烷 |
分析 A、烯烃命名应选取含有双键的最长碳链,以离双键最近为原则命名1号碳;
B、D烷烃命名原则:长-----选最长碳链为主链;多-----遇等长碳链时,支链最多为主链;近-----离支链最近一端编号;小-----支链编号之和最小;
C、醇的命名是从离羟基最近的一端开始编号,羟基位置一样,然后选取离支链最近的一端命名为1号碳.
解答 解:A、2-甲基-3-丁烯,丁烯的命名,编号从距离碳碳双键最近的一端开始,碳碳双键在1号C,甲基中3号C,该有机物正确命名为:3-甲基-1-丁烯,故A错误;
B、4-甲基-3-乙基已烷,名称不符合支链编号之和最小,起点选错,故B错误;
C、醇的命名是从离羟基最近的一端开始编号,羟基位置一样,然后选取离支链最近的一端命名为1号碳,故正确的名称是2-甲基-3-戊醇,故C错误;
D、2,3,3-三甲基戊烷,符合烷烃命名原则,故D正确,
故选D.
点评 本题考查了烷烃的命名,难度不大,要求学生熟练掌握烷烃的命名方法,命名中必须满足主链最长,取代基编号之和最小原则.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷自燃而氮气在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向FeCl3溶液中滴加NaOH溶液 | 制备Fe(OH)3胶体 |
| B | 将CO2通入水玻璃溶液中 | 证明C元素的非金属性大于Si |
| C | 向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤 | 除去苯中混有的苯酚 |
| D | 淀粉与稀H2SO4共热,再加入银氨溶液水浴加热 | 验证淀粉水解产物有无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验结论 |
(1)A的质谱图如图: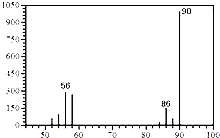 | (1)证明A的相对分子质量为:90. |
| (2)将此9.0g A在足量纯O 2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中. 往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO 2 (标准状况). 往另一份A中加入足量的金属钠充分反应,生成2.24 L H 2(标准状况). | (3)证明A的分子中含有一个羧基和一个羟基. |
(4)A的核磁共振氢谱如图: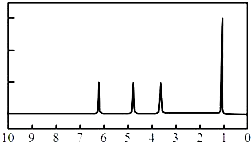 | (4)A的结构简式为:  . . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
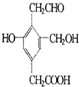 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )| A. | 3:3:2:1 | B. | 6:4:3:2 | C. | 1:1:1:1 | D. | 3:2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①③④⑤ | C. | ①④⑤⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
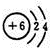 ,A与B在原子的电子层结构上的相同点是最外层均有4个电子.
,A与B在原子的电子层结构上的相同点是最外层均有4个电子.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
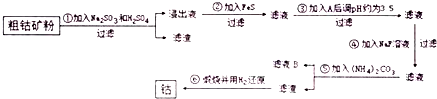
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com