
| A. | 原子半径:B>A,离子半径C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且干燥的单质D有漂白性 |
分析 C原子的最外层电子数是B原子最外层电子数的3倍,则二者的最外层电子数应为偶数,A、B、C原子的最外层电子数之和为12,则A的最外层电子数为偶数,C原子的最外层电子数既是A原子内层电子数的3倍,则C的最外层电子数为6,B的最外层电子数为2,A的最外层电子数为4,则A为C元素,B、C、D位于同一周期,应为第三周期元素,C为S元素,B为Mg元素,则D应为Cl元素,结合元素对应单质、化合物的性质解答该题.
解答 解:C原子的最外层电子数是B原子最外层电子数的3倍,则二者的最外层电子数应为偶数,A、B、C原子的最外层电子数之和为12,则A的最外层电子数为偶数,C原子的最外层电子数既是A原子内层电子数的3倍,则C的最外层电子数为6,B的最外层电子数为2,A的最外层电子数为4,则A为C元素,B、C、D位于同一周期,应为第三周期元素,C为S元素,B为Mg元素,则D应为Cl元素,
根据分析可知:A为C,B为Mg,C为S,D为Cl,
A.A为C、B为Mg,原子半径Mg>C;C为S、D为Cl,硫离子与氯离子的电子层数相同,电荷守恒越大,离子半径越小,则离子半径:C>D,故A错误;
B.Mg与二氧化碳反应的方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,该反应为置换反应,故B正确;
C.B为Mg,D为Cl,二者形成的化合物为离子化合物,故C错误;
D.D为Cl,其单质为氯气,干燥的氯气没有漂白性,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的应用,题目难度中等,推断元素为解答关键,注意根据核外电子关系特点判断元素的种类,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 11.2 g | B. | 5.6g | C. | 8.4g | D. | 2.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的体积分数 | B. | 气体平均相对分子质量 | ||
| C. | 气体的总压强 | D. | 混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期原子半径从左到右依次减小 | |
| B. | 同一主族元素的化学性质相同 | |
| C. | 同一周期元素最高化合价从左到右不一定增大 | |
| D. | 同一主族元素的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将样品配制成溶液V1L,取其中25.00mL恰好与V2mL浓度为cmol/L酸性KMnO4溶液完全反应 | |
| B. | 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg | |
| C. | 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g | |
| D. | 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
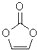
| A. | 1mol该物质最多可与2molH2加成 | B. | 分子式为C3H2O3 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
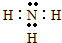
 ,其中含有的化学键有共价键、离子键,属于离子 晶体
,其中含有的化学键有共价键、离子键,属于离子 晶体查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com