
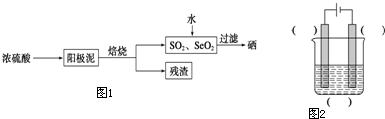
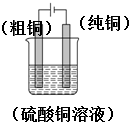

| ||
| ||
 ,
, ;
;
| ||
| ||


科目:高中化学 来源: 题型:
 如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:
如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
A、B、C、D四种原子序数依次增大的元素,分布在三个不同的短周期,其中B与C为同一周期的相邻元素,A与D为同一主族。C的单质是燃料电池的一种原料,D是所在周期原子半径最大的元素。下列说法正确的是( )
A.原子半径:D>C>B>A
B.B的氢化物沸点比C的氢化物的沸点高
C.A与D可形成化合物DA,1mol该物质可与水反应转移的电子数为NA
D.由A、B、C形成的化合物一定只有共价键没有离子键
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com