
【题目】低碳经济是指在可持续发展理念指导下,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。下列是有关碳元素的相关转化,回答下列问题:
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)![]() CH3OH(l) △H=________ kJ/mol。
CH3OH(l) △H=________ kJ/mol。
(2)一定温度下,一定可以提高甲醇合成速率的措施有(______)
a.增大起始通入![]() 值
值
b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,増大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g) ![]() CH3OH(g)已经达到平衡状态的是(______)
CH3OH(g)已经达到平衡状态的是(______)
a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衝转化率如图所示:
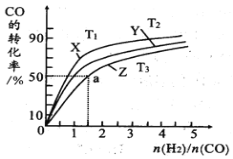
①温度T1°C、T2°C和T3°C由高到低的順序为:_________________;
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为__________,该反应的压强平衡常数Kp的计算式为__________。(Kp生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压强×该物质的物质的量分数)。
【答案】-128.1 CE AC T3>T2>T1 1:1 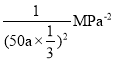
【解析】
(1)三种物质燃烧的热化学方程式为:H2(g)+1/2O2(g)=H2O(l) H=-285.8kJ/mol ①
CO(g)+1/2O2(g)=CO2(g) H=-283.0kJ/mol ②
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) H=-726.5kJ/mol ③
则①×2+②-③得:CO(g)+2H2(g)![]() CH3OH(l) △H=-128.1kJ/mol。
CH3OH(l) △H=-128.1kJ/mol。
答案为-128.1
(2) a.增大起始通入![]() 值,不一定能增大反应物浓度,反应速率不一定加快;
值,不一定能增大反应物浓度,反应速率不一定加快;
b.恒温恒容,再通入氦气,反应物和生成物的浓度都未变,速率不变;
c.使用新型的高效正催化剂,可加快反应速率;
d.将产生的甲醇及时移走,能增大反应物的转化率,但不能加快反应速率;
e.压缩体积,増大压强,可加快反应速率。
故答案为CE。
(3) a.体系中碳氢单键数目不再改变,说明甲醇的量不再改变,反应达平衡状态;
b.若起始投入量之比等于化学计量数之比,则体系中n(CO):n(H2)始终不变,不一定达平衡状态;
c.因反应前后气体分子数不等,所以体系中压强或者平均摩尔质量不再改变,说明反应达平衡状态;
d.单位时间内消耗氢气和CH3OH的物质的量不可能相等,错误。
故答案为AC。
(4) ①因为正反应为放热反应,所以温度越高,反应物的转化率越小。从图中可以看出,相同投料比时,CO的转化率Z<Y<X ,所以T3>T2>T1。答案为T3>T2>T1。
②起始反应物投料比n(H2)/n(CO)=1.5,可设n(H2)=3mol,n(CO)=2mol,
2H2(g)+CO(g) ![]() CH3OH(g)
CH3OH(g)
起始量 3mol 2mol 0
变化量 2mol 1mol 1mol
平衡量 1mol 1mol 1mol
则平衡时CO和CH3OH的分压之比为1:1。答案为1:1;
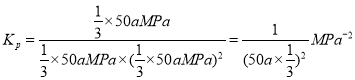
答案为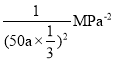 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用元素符号或化学式完成各小题。
IA | ⅡА | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ||||
4 | ② | ④ | ⑩ |
(1)化学性质最不活泼的元素__________________,非金属性最强的元素是___________________。最稳定的气态氢化物是___________________;最高价氧化物对应水化物酸性最强的是_____________________________________________。
(2)金属性最强的单质与水反应的离子方程式为______________。
(3)③⑦⑧⑨四种元素的简单离子半径由大到小的顺序为_________________。
(4)分别写出⑥、⑦和氢形成的气态氢化物的结构式___________________。
(5)用电子式表示②的氧化物的形成过程____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是

A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。填写下列空白:

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式_______________________________________。
(2)B中NaOH溶液的作用是__________________。
(3)试管C中苯的作用是____________________________________。反应开始后,观察D和E两试管,看到的现象为____________________________,此现象可以验证苯和液溴的反应为__________(填反应类型)。
(4)在上述整套装置中,具有防倒吸作用的仪器有________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为![]() 、
、![]() 、
、![]() ,下列说法错误的是
,下列说法错误的是
A.Na3A的第一级水解平衡常数Kh1的数量级为10-2
B.在NaH2A溶液中:![]()
C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者
D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y和Z为原子序数依次增大的六种短周期元素。U为非金属元素,且U与X同主族;V与X两元素的最高正化合价之和为6;W与Y同主族;X的周期数是族序数的3倍;Y的最外层电子数是最内层电子数的3倍。
请推测出U、V、W、X、Y和Z六种元素,并用相应的化学用语或者.化学符号回答下列问题:
(1)V的原子结构示意图为___,W、X、Y三种元素的原子半径由大到小的顺序为___。
(2)物质VU4Z的电子式为___,存在的化学键有___。
(3)U与W能形成的18e-分子的结构式为___,W的化合价为___。
(4)W和U两元素形成的阴离子与V和U两元素形成的阳离子含有相同的电子数,且在水溶液中、加热条件下能够发生反应生成含相同电子数的两种分子,该反应的离子方程式为___。
(5)加热搅拌条件下,XZW3能将强酸性溶液中的Fe2+氧化成Fe3+,当消耗1molXZW3时,转移6mole-,其离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. HF、HCl、H2S、PH3的稳定性依次增强
B. 按Mg、Si、N、F的顺序,原子半径由小变大
C. 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族
D. 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列6种有机物: ①CH3CH2CH2CH3②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() 请回答:
请回答:
(1)属于醇类的是_________(填序号).
(2)与①互为同分异构体的是________(填序号).
(3)与④互为同系物的是_________(填序号).
(4)用系统命名法给③命名,其名称为__________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com