
【题目】某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
(1)①写出未配平的该反应的化学方程式:____→___
②在该反应中,得电子的物质是___,被氧化的元素是___。
③在反应中,每转移1 mol电子,消耗HCl___mol。
④下列叙述中正确的是___(填写字母序号)。
a.在相同条件下,第ⅦA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
(2)①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。该反应的离子方程式为__,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。该反应的化学方程式为___。
②把KI换成KBr,则CCl4层变为____色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____。
③加碘盐中含碘量为20mg·kg-1~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2____L(标准状况,保留2位小数)。
【答案】HCl+SnCl2+H3AsO3 H2SnCl6+As+H2O H3AsO3 Sn 2 a、d Cl2+2I-=I2+2Cl- 5Cl2+I2+6H2O=2HIO3+10HCl 橙 HBrO3>Cl2>HIO3 10.58
【解析】
(1) ① 已知HCl是反应物之一,说明其他物质中氯原子少的为反应物,氯原子多的为生成物,即SnCl2是还原剂,H3AsO3是氧化剂,所以反应方程式为:12HC1+3SnCl2+2H3AsO3
=3H2SnCl6+2As+6H2O。故答案为:HCl+SnCl2+H3AsO3;H2SnCl6+As+H2O;
② 根据反应方程式,得电子物质为H3AsO3,被氧化元素为Sn;故答案为:H3AsO3;Sn
③ 12 mol HCl参加反应共转移6 mol电子,故在反应中,每转移1 mol 电子消耗2 mol HCl;故答案为:2
④a、还原性与失电子能力强弱有关,半径越大,越容易失去最外层电子,还原性越强,在相同条件下第VIA族元素的阴离子随离子半径的增大还原性从上到下逐渐增强,故a正确;
b、氧化性强弱与得电子数目多少无关,与得电子能力强弱有关,得电子越多的氧化剂,其氧化性不一定越强,故b错误;
c、处于中间价态阳离子(如Fe2+)既可作氧化剂,又可作还原剂,故c错误;
d、在相同条件下氧化性顺序Fe3+>Cu2+>H+>Fe2+,故d正确;
答案选a、d;
(2) ①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明氯气和KI发生置换反应生成碘单质,反应方程式为:2KI+Cl2=2KCl+I2,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明碘和氯气发生氧化还原反应生成碘酸,氯气被还原生成HCl,反应方程式为I2+5Cl2+6H2O═2HIO3+10HCl,故答案为:2KI+Cl2=2KCl+I2;I2+5Cl2+6H2O═2HIO3+10HCl;
②氯气的氧化性比溴强,将KI换成KBr,则生成Br2,则CCl4层变为橙色;继续滴加氯水,CCl4层的颜色没有变化,说明氧化性HBrO3>Cl2,根据氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性,则有Cl2>HIO3,所以氧化性顺序为HBrO3>Cl2>HIO3,故答案为:橙;HBrO3>Cl2>HIO3;
③由Cl2+2KI==I2+2KC1 和5Cl2+I2+6H2O==2HIO3+10HCI,两式合并:KI+3Cl2+3H2O=KIO3+6HCl,根据物料守恒得关系式KIO3~I~KI~3Cl2列比例求解: 3Cl2~ I,![]() ,解得V=10.58 L;
,解得V=10.58 L;
故答案为:10.58。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。
(1)某同学用含钠元素的不同类别物质制备NaCl。请再列举3种反应:
①2Na+Cl2![]() 2NaCl
2NaCl
②___;
③___;
④___。
(2)粗盐中一般含有CaCl2、MgCl2、CaSO4和MgSO4杂质。从粗盐制得精盐的过程如下:

①写出MgCl2、CaSO4的电离方程式:___、___。
②各操作分别是:操作a___、操作b___、操作c___。
③试剂Ⅰ是___。
④加入试剂Ⅱ所发生的离子方程式为___,加入试剂Ⅲ所发生的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶4;5Cl2+4Fe![]() 2FeCl2+2FeCl3
2FeCl2+2FeCl3
B.n(Cl2)∶n(FeBr2)=1∶1;Fe2++2Br+Cl2=Fe3++Br2+2Cl
C.n(MnO4-)∶n(H2O2)=2∶3;2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.n(Fe) ∶n[HNO3(稀)]=1∶3;4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O.下列说法错误的是( )
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 molCl2,转移电子的物质的量为2 mol
C. 每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D. 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与“物质的量”相关的计算正确的是( )
A.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体原子个数之比为3∶2∶1
B.28 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
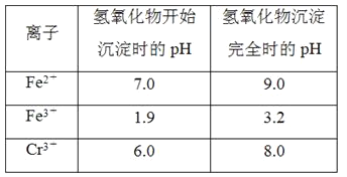
(1)某含铬废水处理的主要流程如图所示:
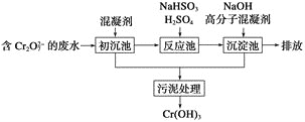
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
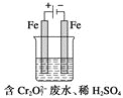
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com