
等电子体具有原子数目相同、电子数目相同的特征。下列各组中物质属于等电子体的是
A.NO和O2+ B.CO和NO C.NO2和CO2 D. SO2和ClO2
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
| 300℃ | K2O.N2 |
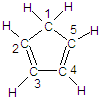 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是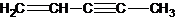 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省三明一中高一上学期入学考试化学试卷(带解析) 题型:单选题
等电子体具有原子数目相同、电子数目相同的特征。下列各组中物质属于等电子体的是
| A.NO和O2+ | B.CO和NO | C.NO2和CO2 | D.SO2和ClO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com