

分析 铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3等杂质,将铬铁矿和氢氧化钠、空气混合焙烧,发生反应得到Na2CrO4、NaAlO2、NaOH、Na2SiO3、NaFeO2,然后水浸、过滤得到滤渣1和浸出液,浸出液中溶质是Na2CrO4、NaAlO2、NaOH、Na2SiO3,根据信息①知,滤渣1为Fe(OH)3,在浸出液中加入试剂a调整溶液PH,试剂a应为酸,依据流程中分离出的物质可知,加入酸为硫酸,溶液中偏铝酸钠、Na2SiO3、NaOH与硫酸溶液生成硅酸沉淀和氢氧化铝沉淀,然后过滤得到滤液和滤渣2,滤渣2是H2SiO3、Al(OH)3,滤液中含有Na2CrO4、和Na2SO4,加入硫酸继续调节溶液的pH,根据信息②知,溶质变为Na2Cr2O7,将混合溶液蒸发浓缩、冷却结晶得到Na2Cr2O7晶体,和滤液为Na2SO4.
(1)根据发生的反应确定固体产物成分;FeO•Cr2O3和氧气发生氧化还原反应;
(2)结合题给信息确定滤渣成分,浸出液的成分除Na2CrO4、NaOH外,还含有NaAlO2、NaOH、Na2SiO3,NaFeO2在水溶液中强烈水解生成对应的氢氧化物,所以滤渣1为Fe(OH)3;
(3)上述分析可知试剂A为硫酸;
(4)酸性过强,产品Na2Cr2O7晶体中可能含有铝离子,偏铝酸钠和适量硫酸反应生成氢氧化铝沉淀,氢氧化铝会溶解于氢氧化铝生成铝离子;
(5)依据元素守恒分析计算;
(6)阳极是活性电极时,阳极本身失电子,生成阳离子.
解答 解:(1)通过以上分析知,“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有NaAlO2、Na2SiO3,铬元素化合价+3价,铁元素化合价为+2价,被氧气氧化生成铬酸钠和NaFeO2,铬元素化合价变化为+6价,铁元素化合价变化为+3价,电子转移总数为34,据此电子守恒和原子守恒配平书写得到焙烧过程中发生的氧化还原反应为4FeO•Cr2O3+7O2+10Na2CO3$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+4NaFeO2+10CO2,4FeO•Cr2O3反应电子转移28,每熔化1mol FeO•Cr2O3,转移的电子数为$\frac{28}{4}$mol×6.02×1023=4.214×1024,
故答案为:4;10Na2CO3;8;4;10CO2;4.214×1024;
(2)浸出液中溶质是Na2CrO4、NaAlO2、NaOH、Na2SiO3,浸出液的成分除Na2CrO4、NaOH外,还含有NaAlO2、Na2SiO3,NaFeO2在水溶液中强烈水解生成对应的氢氧化物,所以滤渣1为Fe(OH)3,
故答案为:NaAlO2、Na2SiO3;Fe(OH)3;
(3)由分析可知,流程最后分离得到硫酸钠,加入的试剂a为硫酸,用来调节溶液PH,
故答案为:H2SO4 ;
(4)该流程中用了两步调节pH,若合并成一步调pH,酸性过强,产品Na2Cr2O7晶体中可能含有较多杂质,可能含有铝离子,偏铝酸钠和适量硫酸反应生成氢氧化铝沉淀,氢氧化铝会溶解于氢氧化铝生成铝离子,AlO2-+H++H2O=Al(OH)3,Al(OH)3+3H+=Al3++H2O,引入该杂质的原因用离子方程式说明为:AlO2-+4H+=Al3++2H2O或AlO2-+H++H2O=Al(OH)3,Al(OH)3+3H+=Al3++3H2O,
故答案为:AlO2-+4H+=Al3++2H2O或AlO2-+H++H2O=Al(OH)3,Al(OH)3+3H+=Al3++3H2O;
(5)100kg铬铁矿(含FeO•Cr2O3 89.6%)含FeO•Cr2O3物质的量=$\frac{100000g×89.6%}{224g/mol}$=400mol,结合铬元素守恒,获得Na2Cr2O7•2H2O的物质的量也为400mol,最多可获得Na2Cr2O7•2H2O的质量400mol×298g/mol=119200g=119.2kg,
故答案为:119.2;
(6)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,
故答案为:Fe-2e-=Fe2+.
点评 本题考查了以铬铁矿为原料制备重铬酸钠(Na2Cr2O7)的流程,侧重考查物质分离提纯的实验过程分析判断,主要是物质性质和试剂选择、试剂反应的产物分析应用,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.4 g | B. | 4.8 g | C. | 2.4 g | D. | 1.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 标准状况下,1mol物质的体积为22.4L | |
| C. | H2、O2、N2、CO2组成的混合气体1mol在标准状况下的体积约为22.4L | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Fe2+、Cl-、SO42- | B. | Mg2+、Fe3+、NO3-、SCN- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ba2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比 | |
| B. | 硫化钾溶液中c(K+)与c(S2-)之比 | |
| C. | 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比 | |
| D. | 10mL 0.5mol•L-1的盐酸溶液与5mL 0.5mol•L-1的醋酸溶液中的n(H+)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
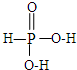 ,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.
,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 碱性:Na2CO3<NaHCO3 | |
| C. | 水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 与足量的盐酸反应产生的气体的体积:Na2CO3<NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com