
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol?L-1NaOH溶液 | 0.1mol?L-1MgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol?L-1氨水 | 0.1mol?L-1MgCl2溶液 | 无现象 |
| Ⅲ | 1mol?L-1氨水 | 1mol?L-1MgCl2溶液 | 现象III |
| Ⅳ | 1mol?L-1氨水 | 0.1mol?L-1MgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol?L-1氨水 | 1mol?L-1MgCl2溶液 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g/cm3.该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g/cm3.该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有FeCl3、FeCl2、CuCl2的混合溶液1L,将0.70mol的铁粉慢慢加入混合液中并充分搅拌,溶液中的三种金属阳离子的物质的量随铁粉加入量的变化曲线如图所示,D点坐标是(0.4,0),H点坐标是(0.7,0.2).
现有FeCl3、FeCl2、CuCl2的混合溶液1L,将0.70mol的铁粉慢慢加入混合液中并充分搅拌,溶液中的三种金属阳离子的物质的量随铁粉加入量的变化曲线如图所示,D点坐标是(0.4,0),H点坐标是(0.7,0.2).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+比H+的氧化性强,故镁将Fe3+还原完全后再与H+反应 |
| B、镁和生成的铁构成许多微型原电池,故反应剧烈 |
| C、反应放热温度升高,故反应剧烈 |
| D、反应产物含有Fe(OH)3、Fe、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
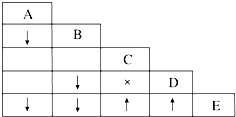 有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、BaCl2溶液、K2CO3溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各取少量,多次进行两两混合反应,反应现象如表所示.表中“↓”表示生成沉淀,“↑”表示生成气体,“×”表示没有明显现象,空格表示实验未做.
有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、BaCl2溶液、K2CO3溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各取少量,多次进行两两混合反应,反应现象如表所示.表中“↓”表示生成沉淀,“↑”表示生成气体,“×”表示没有明显现象,空格表示实验未做.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com