


分析 锌比铜活泼,能与稀硫酸反应,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲没有形成闭合回路,不能形成原电池,乙形成闭合回路,形成原电池,根据原电池的组成条件和工作原理解答该题.
解答 解:①a.没有形成闭合回路,不能形成原电池,故错误;
b.两烧杯中硫酸都参加反应,氢离子浓度减小,溶液的pH均增大,故正确;
c.铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲烧杯中铜片表面没有气泡产生,故错误;
d.乙能形成原电池反应,活泼金属锌为负极,铜为正极,阴离子移向负极,所以SO42-向锌片移动,故正确;
故答案为:bd;
②乙形成闭合回路,形成原电池,活泼金属锌为负极,铜为正极,导线中电子由负极流向正极铜,故答案为:铜;
③在乙实验中,如果把硫酸换成硫酸铜溶液,Cu2+在正极上得电子被还原产生Cu,电极反应式为Cu2++2e-=Cu,负极锌反应为Zn-2e-=Zn2+,所以若实验中有0.2mol电子通过导线,溶液的质量将增加0.1×65-0.1×64=0.1g,故答案为:Cu2++2e-=Cu,0.1;
④甲没有形成闭合回路,不能形成原电池,只发生锌与硫酸反应生成硫酸锌和氢气,该反应为放热反应,则反应物总能量大于生成物总能量,所以能正确表示装置甲中反应过程能量变化的是a,故答案为:a.
点评 本题考查原电池的组成和工作原理,题目难度不大,注意基础知识的积累.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 裂解和裂化均为化学变化 | |
| B. | 乙烯、苯分子中的所有原子都在同一平面上 | |
| C. | 裂化和裂解均是将相对分子质量大的烃断裂成相对分子质量小的烃的过程 | |
| D. | 实验室蒸馏石油的实验中,冷凝管的水流方向是上方进水下方出水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键是阴、阳离子之间的相互吸引力 | |
| B. | 电能是一种使用最方便、污染最小的一次能源 | |
| C. | 由分子构成的物质中一定存在共价键 | |
| D. | 决定化学反应速率的主要因素是反应物体本身的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的燃烧过程均是放热的 | |
| B. | 需要点燃才能发生的燃烧过程是吸热的 | |
| C. | 所有燃料在燃烧过程中均会发生化学键的断裂 | |
| D. | 燃烧后产物的总能量一定小于反应物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
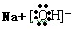 ,含有化学键的类型离子键、极性键;
,含有化学键的类型离子键、极性键; 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ | |
| B. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 向沸水中滴加饱和氯化铁溶液制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水混合,水层褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 乙烷与氯气反应制氯乙烷 | |
| D. | 苯和氯气在一定条件下生成六氯环已烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com