
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£�
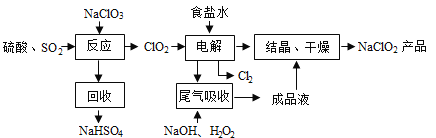
�ش��������⣺
��1������⡱����ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱΪ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�
Ϊ______��________��
��2��д������Ӧ������������ClO2�Ļ�ѧ����ʽ____________��
��3��ʵ������ԭ����������Ũ����ϡ�Ͷ���ã�д��ʵ�����_____________��
��4����β�����ա������ա���⡱�����ų�������ClO2�������շ�Ӧ�У��������뻹ԭ��������
����֮��Ϊ_______��
��5����lmol SO2��lmol Cl2ͨ��ˮ���γ�lL����Һ��������Һ��������Ũ��Ϊ_______mol/L��
���𰸡���1��NaOH��Na2CO3����2��2NaClO3+SO2+H2SO4=2NaHSO4+ClO2����
��3����Ũ���������ձ���������ע��ˮ������Ͻ�����4��2��1����5��4
��������
�������������ˮ����ʱΪ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�ΪNaOH��Na2CO3����2��NaClO3��SO2��H2SO4�ữ����������ClO2������NaClO2������������ԭ����ΪNaCl�����ݵ����غ��ԭ���غ㣬�˷�Ӧ�Ļ�ѧ����ʽΪ2NaClO3+SO2+H2SO4=2NaHSO4+ClO2������3��Ũ����ϡ�͵ķ����ǣ���Ũ���������ձ���������ע��ˮ������Ͻ��裬����Ũ��������ˮ���������������Һ�ηɽ�����4��ͼʾ��֪���ú��й��������NaOH��Һ��ԭClO2���壬����ΪNaClO2��������շ�Ӧ�У�������ΪClO2����ԭ����ΪNaClO2���ȵĻ��ϼ۴�+4�۽���Ϊ+3�ۣ���ԭ��ΪH2O2����������ΪO2����֪ÿĦ��H2O2ʧ2mol���ӣ����ݵ����غ��֪�������ͻ�ԭ�������ʵ���֮��Ϊ2:1����5������SO2+C12+2H2O=2HCl+H2SO4��֪��������Һ��������Ũ��Ϊ4mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��������٤��������ֵ������������ȷ���ǣ� ��
A����״���£�18gH218O����������Ϊ10NA
B��1 mol�Ҵ��к��м��Լ�����ĿΪ8NA
C��1mol�ĩ�NH2��1molNH4+������������Ϊ10NA
D��1 mol Na2O��Na2O2�����������������������3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A.3p2��ʾ3p�ܼ����������
B.ͬһԭ���У�1s��2s��3s����������С
C.�������������ԭ�ӽ�����̬ԭ��
D.ͬһԭ���У�2p��3p��4p�ܼ��Ĺ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ɻ�ͭ����Ҫ�ɷ�CuFeS2��ұ��ͭ����Ҫ�������£�
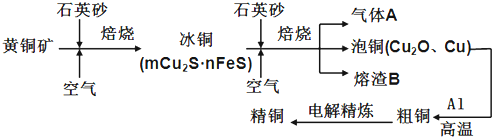
��1������A�еĴ�����Ⱦ���ѡ�������Լ��е� ���գ�
a��ŨH2SO4 b��ϡHNO3 c��NaOH��Һ d����ˮ
��2����ϡH2SO4��������B��ȡ����������Һ���μ�KSCN��Һ��ʺ�ɫ��˵����Һ�д��� �������ӷ��ţ���������Һ�л�����Fe2+�ķ�����
��3������ͭұ����ͭ�Ļ�ѧ��Ӧ����ʽΪ ��
��4��ȡһ��������ͭ������1L0.6mol/LHNO3��Һǡ����ȫ�ܽ⣬ͬʱ�ų�2240mLNO���壨��״��������ȡ��������ͭ����������H2��ԭ���õ���ͭ������Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º����£���һ����ܱ�������ͨ��һ����������A���������·�Ӧ��3A��g��![]() 2B��g��+xC��g������ƽ���������ڵ�ѹǿ������p%��A��ƽ��ת����Ϊa%���������ƶ�����ȷ���ǣ� ��
2B��g��+xC��g������ƽ���������ڵ�ѹǿ������p%��A��ƽ��ת����Ϊa%���������ƶ�����ȷ���ǣ� ��
A. ��x=2����p��0.5a B. ��x=3����p��0.7a
C. ��x=4����p= a D. ��x= 5����p��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(15��)ijѧ���о�С����̽��CuSO4��Һ��Na2CO3��Һ��ϲ���������ɫ������ɣ�С���������ʵ��̽����
��������衿
����1������ΪCu(OH)2������2�����ó���Ϊ_____________��
����3�����ó���Ϊ��ʽ̼��ͭ[��ѧʽ�ɱ�ʾΪnCu(OH)2��mCuCO3]��
���������ϡ���������һ�ֳ������Ⱦ��ֽ⣨����������ᾧˮ����
�����ʳɷ�̽����
����1������������Һ���ˣ�������ˮϴ�ӣ�������ˮ�Ҵ�ϴ�ӣ�
����2����ͬѧȡһ�������ù��壬�����������õ���ͼװ�ã��г�����δ���������ж���ʵ�顣
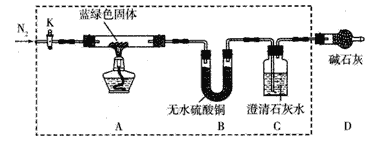
��ش��������⣺
��1������2�еij�����Ϊ______________��
��2������1�г���ΪCu(OH)2������������_________________��
��3����ˮ�Ҵ�ϴ�ӵ�Ŀ��__________________��
��4������Ӧ��A������ɫ�����ڣ�C������������֤������________________����д��ţ�������
��5����ͬѧ��ΪֻҪ����ͼ��Bװ�õ��Լ�����_______________�Լ������֤�������м��衣
��6����ͬѧ����B�Լ�����֤����3������ʵ��������___________________��
��7���ڼ���3������ǰ���£�ijͬѧ������Ba(OH)2����Ca(OH)2���ⶨ����ɫ����Ļ�ѧʽ������ȡ����ɫ��������Ϊ27.1g��ʵ�������װ��B����������2.7g��C�еIJ�������������Ϊ19.7g���������ɫ����Ļ�ѧʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʽṹ��˵����ȷ���ǣ� ��
A. ���Ӳ������ԭ�ӵİ뾶һ�����ڵ��Ӳ����ٵ�ԭ�ӵİ뾶
B. P4S3�����и�ԭ�ӵ��������Ѵﵽ��8�����ȶ��ṹ��������й��ۼ���ĿΪ9��
C. H2SO3����ǿ��H2CO3�����Էǽ�����S����C
D. ��ͬԭ���γɵĻ�������һ��ֻ�����Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����������������ڷ�Ӧ�����������ǣ� ��
A. ̼������ȷֽ� B. �Ҵ�ȼ�� C. �������������Ʒ�Ӧ D. ����������ˮ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com