
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族)____________________。
(2)8个元素的最高价氧化物的水化物中,酸性最强的是___________________(填化学式)。
(3)①元素和⑥元素形成化合物的电子式是 ___________________________ 。
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:_______________________________________________ 。
(5)下列叙述正确的是______________(填字母)。
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性
【答案】 第二周期第ⅥA族 HClO4 ![]() Al(OH)3 + 3H+ = Al3+ + 3H2O A、B、D
Al(OH)3 + 3H+ = Al3+ + 3H2O A、B、D
【解析】(1)第二、三周期元素中,①③均有+1价,处于IA族,原子半径①>③,则①为Na、③为Li;⑤⑦均有+5、-3价,原子半径⑤>⑦,则⑤为P元素、⑦为N元素;②有+2价,处于ⅡA族,原子半径大于P,故②为Mg;③有+3价,处于ⅢA族,原子半径大于P,故③为Al;⑥有+7、-1价,则⑥为Cl;⑧有-2价,处于VIA族,原子半径小于氯,故⑧为O元素,在元素周期表中的位置是:第二周期VIA族;(2)非金属性越强,最高价氧化物水化物的酸性越强,8个元素的最高价氧化物的水化物中,酸性最强的是HClO4;(3)①元素和⑥元素形成化合物为NaCl,电子式是![]() ;(4)④最高价氧化物对应水化物为Al(OH)3,⑥的氢化物水溶液为盐酸,二者反应的离子方程式:Al(OH)3+3H+=Al3++3H2O;(5)A.③为Li,处于第二周期,④为Al,处于第三周期,A正确;B.②的阳离子镁离子核外电子数为10、⑧的阴离子O2-的核外电子数为10,B正确;C.在同主族元素中F元素非金属性比Cl的强,C错误;D.⑤为P元素、⑦为N元素,两者核电荷数之差是8,D正确;E.①与⑧形成的化合物为氧化钠、过氧化钠,不是两性氧化物,E错误,答案选ABD。
;(4)④最高价氧化物对应水化物为Al(OH)3,⑥的氢化物水溶液为盐酸,二者反应的离子方程式:Al(OH)3+3H+=Al3++3H2O;(5)A.③为Li,处于第二周期,④为Al,处于第三周期,A正确;B.②的阳离子镁离子核外电子数为10、⑧的阴离子O2-的核外电子数为10,B正确;C.在同主族元素中F元素非金属性比Cl的强,C错误;D.⑤为P元素、⑦为N元素,两者核电荷数之差是8,D正确;E.①与⑧形成的化合物为氧化钠、过氧化钠,不是两性氧化物,E错误,答案选ABD。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)在室温下稳定,加热至350℃左右,迅速分解。微溶于水,不溶于乙醇,可溶于稀酸生成过氧化氢。实验室用如下方法制备CaO2并测定其纯度。过氧化钙的制备实验装置和步骤如下:
将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2![]() 3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
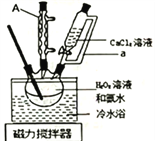
(1)仪器A的名称为:_____________________;恒压分液漏斗的导管a的作用为_________________。
(2)三颈烧瓶中发生反应的化学方程式为___________________________;将三颈烧瓶置于冷水浴中,其主要目的为________________________________。
(3)用无水乙醇代替水洗涤的目的是:___________________________;判断脱水干燥是否完全,需要至少冷却后称重____________次。
(4)过氧化钙纯度的测定,装置如下图所示:
检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0-1mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2mL,设在此温度和压强下气体摩尔体积为VmL·mol-1,则样品中CaO2的质量分数为___________%。
(5)过氧化钙用于长途运输鱼苗,可能的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列结论错误的是 ( )

A. 完全电解2 mol H2O断裂的σ键键数为4NA
B. 标准状况下,11.2 L CO2中含有的π键键数为2NA
C. 60 g SiO2晶体中含有的Si—O键键数为4NA
D. 128 g金属铜中含有如图所示的晶胞数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
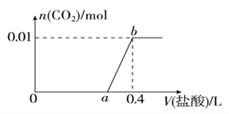
A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为_________________________________________________________________。
(2)30Si原子的中子数为________;SiO2的晶体类型为________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al3O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )

A. γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B. α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D. 三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解粗盐水(含Na+、Cl-和少量Mg2+、Br-)的装置如图所示(a、b均为石墨电极),下列说法正确的是

A. 电池工作时,负极反应式为:H2-2e-+2OH-=2H2O
B. a极的电极反应式为:2H++2e-=H2↑
C. 电解过程中电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.1 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2 200℃,熔融态不导电________;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电________;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中________;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________________________________________________________________________。
试推测ICl的沸点所处的最小范围________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.FeCl3 == Fe3+ + Cl3—
B.H2SO4 == 2H+ + SO42-
C.NaOH == Na+ + O2- + H+
D.Ca(NO3)2 == Ca2+ + 2(NO3)2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com