
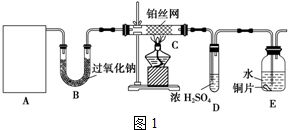
分析 (1)铵盐受热分解产生氨气,过氧化钠可以吸收二氧化碳,根据药品的状态和反应条件选择合适的装置;
氨气极易溶于水,实验会倒吸,氨气有毒,需要尾气处理;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,与水反应生成氢氧化钠和氧气,据此写出反应的方程式;装置E中氧气足量,NO与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,硝酸与铜反应生成硝酸铜、一氧化氮和水,据此写出反应的离子方程式;
(3)装置C中氨气与氧气催化氧化生成氨气和水,据此写出反应的方程式.
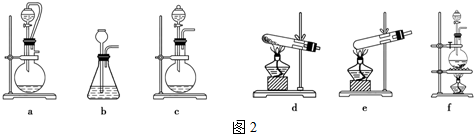
解答 解:(1)铵盐受热分解产生氨气,过氧化钠在此装置中可以吸收二氧化碳和水,所以制取氨气的药品可以用NH4HCO3或(NH4)2CO3,药品均为固体,选择的装置符合加热固体制气体,应该选用d装置;
氨气极易溶于水,该装置会发生倒吸,应该在装置C与D之间增加一个防倒吸装置;氨气有毒,缺少尾气处理装置,会污染环境,需要尾气处理,要在D后增加一个尾气吸收装置,
故答案为:②;d;D中液体可能会倒吸;缺少尾气处理装置,会污染环境;
(2)图1装置B中过氧化钠与水反应生成氢氧化钠和氧气,二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2;
在图1中,若A、B处试剂足量,则NO与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,生成的硝酸能够与铜片反应生成硝酸铜、一氧化氮气体和水,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2(Na2O2与水或Na2O2与CO2的反应写一个即可);3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)图1装置C中氨气催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
点评 本题考查了氨气的制取和性质,题目难度中等,明确氨气的性质及制备原理为解答关键,注意掌握化学实验基本操作方法,试题侧重考查学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 苯中碳碳键是介于C-C和C=C之间的一种特殊共价键 | |
| B. | 甲烷、乙烯都能使酸性KMnO4溶液褪色 | |
| C. | 葡萄糖溶液中加入银氨溶液,水浴加热有银镜生成 | |
| D. | 医用酒精能使蛋白质变性,可用于消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.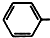 CH2OCH2CH2CHO
CH2OCH2CH2CHO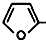 CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3.
COOCH2CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤对电子 | |
| C. | 沉淀溶解后将生成深蓝色的正四面体形的配离子[Cu(NH3)4]2+ | |
| D. | 加入极性较小的溶剂乙醇后,将析出[Cu(H2O)4]SO4•H2O晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SO3都是极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水不能鉴别苯和溴苯 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| D. | 某有机物的分子结构如图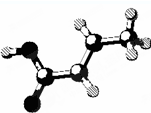 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com