
工业接触法制硫酸的简单流程图如下:
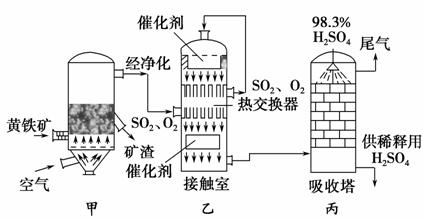
(1)写出装置甲的名称________。要使黄铁矿充分和迅速地燃烧,工业上常采取的措施为__________________________________。
(2)接触室中二氧化硫与氧气的反应采用________(填“常压”或“高压”),原因是____________________________________________________。
(3)刚通入接触室中的SO2和O2在热交换器的管道________(填“里”或“外”)流动,在催化剂表面接触反应的SO2和O2在热交换器的管道________(填“里”或“外”)流动,这样两种流体通过管壁进行热交换。
(4)在吸收塔中为什么用98.3%的浓硫酸而不是用水吸收三氧化硫?______________________________________________________________。
(5)工业接触法制硫酸的过程中,有两个操作过程采用了逆流的原理,它们分别是________________________________________________,
________________________________。
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
在某100 mL混合酸中,HNO3的物质的量浓度为0.4 mol·L-1,H2SO4的物质的量浓度为0.2 mol·L-1,向其中加入2.56 g铜粉微热,待充分反应后,溶液中Cu2+的物质的量浓度约为( )
A.0.15 mol·L-1 B.0.3 mol·L-1 C.0.25 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到2molFe(OH)3沉淀,此时共消耗的水的物质的量为()
A. 2 mol B. 3 mol C. 4 mol D. 5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
石膏也可用于工业生产二氧化硫,进而生产硫酸。天然石膏的化学式为CaSO4·2H2O。将天然石膏脱水后,第2步化学反应就可制得二氧化硫。
(1)写出第1步反应的化学方程式__________________________________。
(2)在第2步化学反应中,下列原料可以使用的是(用序号填空)__________。
写出有关化学反应的方程式_________________________________________
_________________________________________________________________。
①空气 ②氧气 ③硫酸 ④焦炭
(3)在第2步化学反应中,可能会排入空气的气态污染物是________。它(或它
们)的主要危害是__________________________________________________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为 ( )
A.1 mol·L-1 B.2.5 mol·L-1
C.5 mol·L-1 D.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题:

 H++
H++ 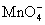 + H2C2O4==== CO2↑+ Mn2++
+ H2C2O4==== CO2↑+ Mn2++
(1)配平以上离子方程式,并在 中填上所需的微粒。
(2)该反应中的还原剂是 。
(3)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为 mol。
(4)测定血钙的含量的方法:取2 mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是 。
②溶解沉淀时 (“能”或“不能”)用稀盐酸,原因是 。
③若消耗了1.0×10-4mol·L-1的KMnO4溶液20.00 mL,则100 mL该血液中含钙
g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是( )
|
| A. | 从1L 1mol•L﹣1的NaCl溶液中取出10mL,其浓度仍是1mol•L﹣1 |
|
| B. | 制成0.5L 10mol•L﹣1的盐酸,需标准状况下氯化氢气体112L |
|
| C. | 0.5L 2mol•L﹣1 BaCl2溶液中,Ba2+和Cl﹣总数为3×6.02×1023 |
|
| D. | 10g 98%硫酸(密度为1.84g•cm﹣3)与10mL 18.4 mol•L﹣1硫酸的浓度是不同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com