
等物质的量浓度、等体积的下列溶液中:
①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3、⑤(NH4)2CO3,下列关系或者说法正确的是( )
A.c(CO32—)的大小关系为:②>⑤>③>④>①
B.c(HCO3—)的大小关系为:④>③>⑤>②>①
C.将溶液蒸干灼烧后只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 9-3 人工合成有机化合物练习卷(解析版) 题型:选择题
一次性使用的聚苯乙烯( )材料易造成“白色污染”,其替代物聚乳酸(
)材料易造成“白色污染”,其替代物聚乳酸( )是由乳酸(
)是由乳酸(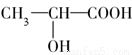 )聚合而成的,聚乳酸可在乳酸菌的作用下降解。下列说法正确的是( )
)聚合而成的,聚乳酸可在乳酸菌的作用下降解。下列说法正确的是( )
A.聚苯乙烯的单体为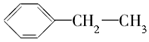
B.聚苯乙烯的聚乳酸的聚合方式相似
C.聚苯乙烯和聚乳酸均为纯净物
D.乳酸可发生消去反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:填空题
如图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42—离子物质的量浓度的对数,回答下列问题。
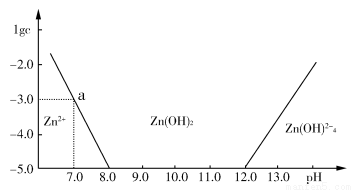
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(4)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是________(填字母序号)。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:填空题
已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释NaHC2O4溶液显酸性的原因:________________。
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较所得溶液中各种离子浓度的大小关系:________________。
(3)配平以下氧化还原反应方程式。
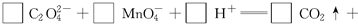
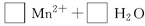
(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份该溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加20 mL 0.25 mol/L NaOH溶液时,溶液由无色变为浅红色。该溶液中被中和的H+的物质的量为________mol。
②第二份溶液中滴加16mL 0.10mol/L酸性KMnO4溶液时反应完全,该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的物质的量为________mol,KHC2O4的质量分数为________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
常温下,将a L 0.1 mol·L-1的NaOH溶液与b L 0.1 mol·L-1的CH3COOH溶液混合,下列有关混合溶液的说法一定不正确的是 ( )
A.a<b时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.a=b时,c(CH3COOH)+c(H+)=c(OH-)
D.无论a、b有何关系,均有c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:填空题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HB物质的量浓度(mol/L) | KOH物质的量浓度(mol/L) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c1 | 0.2 | pH=7 |
丙 | 0.1 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol/L________?(填“是”或“否”)。混合溶液中离子浓度c(B-)与c(K+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,HB是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算),c(K+)-c(B-)=_mol/L。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
下列叙述正确的是 ( )
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a=b+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c(NH4+) = c(Cl-)
C.25℃ 0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大
D.100℃时,KW=10-12,若pH=1的盐酸与pH=11 NaOH溶液混合后,溶液的pH=6,则盐酸与NaOH溶液体积比为1∶1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈酸性的是( )
H++OH-向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液
D.将水加热到100°C,使pH=6
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
在A(g)+pB(g)=qC(g)的反应中,经t秒后C的浓度增加mmol·L-1,则B浓度的变化来表示的反应速率是 ( )
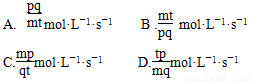
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com