
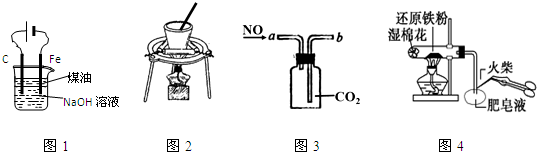
| A. | 图1:实验室制备Fe(OH)2 | |
| B. | 图2:从NaCl与I2的混合物中回收I2 | |
| C. | 图3:收集NO气体 | |
| D. | 图4:检验铁粉与水蒸气反应产生的氢气 |
分析 A.Fe作阴极,不能失去电子;
B.碘易升华,坩埚用于固体加热分解及结晶水测定实验;
C.NO与二氧化碳不反应,短进长出可排出二氧化碳;
D.Fe与水蒸气高温下反应生成氢气,氢气具有可燃性.
解答 解:A.Fe作阴极,不能失去电子,则图中Fe与电源负极相连,不能制备Fe(OH)2,故A选;
B.碘易升华,坩埚用于固体加热分解及结晶水测定实验.应利用蒸发皿、玻璃片分离,故B选;
C.NO与二氧化碳不反应,短进长出可排出二氧化碳,则图中装置可收集NO,故C不选;
D.Fe与水蒸气高温下反应生成氢气,氢气具有可燃性,则图中装置可检验铁粉与水蒸气反应产生的氢气,故D不选;
故选AB.
点评 本题考查化学实验方案的评价,为高频考点,把握电解原理、混合物分离、气体的收集等为解答的关键,侧重分析与应用能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题

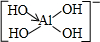 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电极Ⅰ发生还原反应 | B. | 电流方向:电极Ⅳ→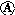 →电极Ⅰ →电极Ⅰ | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4 HCl BaCl2 | B. | Na2CO3 K2SO4 KCl | ||
| C. | FeCl3 NaCl KOH | D. | CuSO4 HCl NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | . 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 新制的氢氧化铜悬浊液 | D. | 氯化铁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com