
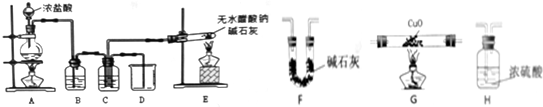
| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
分析 (1)依据原子守恒判断产物的化学式;
(2)装置A是氯气发生装置,生成的氯气中含氯化氢气体,需要通过饱和食盐水除去,装置E是甲烷气体发生装置,氯气和甲烷按照1:1体积混合光照发生取代反应,装置C中是饱和食盐水减少氯气的溶解,使甲烷和氯气混合均匀,反应得到四种取代产物和氯化氢气体,通过D使C连通大气,平衡压强,接收可能溢出的液体;
(3)①为了测定X为CH4的组成,利用装置E制备甲烷,得到气体通过装置G中的氧化铜反应,用浓硫酸吸收生成水,用碱石灰吸收生成的二氧化碳;
②实验数据只能计算碳和氢元素物质的量之比,不能确定是否含氧元素;
F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H 中吸收的是水蒸气,H2O质量5 1.4g-42.4g=9.0g,n(H)=$\frac{9g}{18g/mol}$×2=1.0mol;故n(C):n(H)>1:4,碱石灰会吸收空气中二氧化碳、水蒸气导致误差产生.
解答 解:(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,由原子守恒,可知X的化学式是CH4,
故答案为:CH4;
(2)装置A是氯气发生装置,生成的氯气中含氯化氢气体,需要通过饱和食盐水除去,装置E是甲烷气体发生装置,氯气和甲烷按照1:1体积混合光照发生取代反应,装置C中是饱和食盐水减少氯气的溶解,使甲烷和氯气混合均匀,反应得到四种取代产物和氯化氢气体,通过D使C连通大气,平衡压强,接收可能溢出的液体;
①C装置中盛有饱和食盐水,故答案为:饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl,光照后氯气和甲烷发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢,故答案为:除去Cl2中含有的HCl;5;
③装置D的作用是:连通大气,平衡压强;接收可能溢出的液体,故答案为:连通大气,平衡压强;接收可能溢出的液体;
(3)①为了测定X为CH4的组成,利用装置E制备甲烷,得到气体通过装置G中的氧化铜反应,生成水和二氧化碳,用浓硫酸吸收生成水,用碱石灰吸收生成的二氧化碳,装置连接顺序为EGHF,
故答案为:G、H、F;
②实验数据只能计算碳和氢元素物质的量之比,不能确定是否含氧元素,所以应依据质量守恒分析判断是否含氧元素,需要称取C装置实验前后的质量;
F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H 中吸收的是水蒸气,H2O质量5 1.4g-42.4g=9.0g,n(H)=$\frac{9g}{18g/mol}$×2=1.0mol;故n(C):n(H)>1:4,所以计算结果可知测得有误差,原因是F 装置后面与空气接触,空气中的水蒸气和CO2 进入了F 装置,造成含碳量偏大,
故答案为:数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C 装置实验前后的质量;F 装置后面与空气接触,空气中的水蒸气和CO2进入了F 装置,造成含碳量偏大.
点评 本题考查了物质性质实验分析和实验方案设计,主要是物质组成的实验测得方法,掌握实验基础和物质性质是解题关键,题目难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | Li能在空气中燃烧 | B. | Li2O熔点较低 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热时易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.
Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
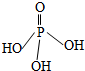 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na3P3O10 | |
| C. | 按上述原理,四聚磷酸的化学式为H6P4O13 | |
| D. | 多聚磷酸的结构可表示为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期第VA族的元素 | ||
| C. | 砷原子的M电子层有8个电子 | D. | 砷的氧化物的水溶液呈强碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com