
| A. | 氨水 | B. | NaOH溶液 | C. | 硝酸 | D. | 酒精 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 气体的总物质的量 | ||
| C. | 消耗1摩尔A同时生成1摩尔D | D. | 混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
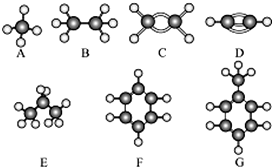 已知A~G是几种烃分子的球棍模型,据此回答下列问题:
已知A~G是几种烃分子的球棍模型,据此回答下列问题: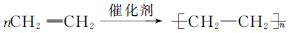 .
.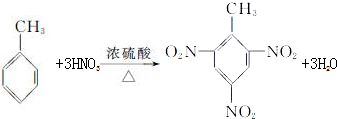 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层数逐渐增多 | B. | 原子核吸引电子的能力逐渐增强 | ||
| C. | 最高正价数值逐渐增大 | D. | 从硅到氯负价从-4到-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | ZnO | C. | Zn | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com