
| A. | 常温下稀释溶液0.1mol•L-1CH3COONa溶液,$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| B. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度 | |
| D. | 等浓度的NaCl和CH3COONa等体积混合,则混合溶液中:c(Na+)>c(Cl-)>c(OH-)>c(CH3COO-)>c(H+) |
分析 A.$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$为醋酸根离子的水解平衡常数,只与温度有关,与溶液浓度大小无关;
B.二者恰好反应生成等浓度的硫酸钠和硫酸铵,根据混合液中的电荷守恒和物料守恒判断各离子浓度大小;
C.酸溶液中的氢离子、碱溶液中的氢氧根离子抑制了水的电离,抑制程度与氢离子、氢氧根离子浓度有关;
D.醋酸根离子的水解程度较小,则氢离子浓度远远小于醋酸根离子浓度.
解答 解:A.常温下稀释溶液0.1mol•L-1CH3COONa溶液,其水解平衡常数$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$的值不变,故A错误;
B.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中,溶质为等浓度的硫酸铵和硫酸钠,由于铵根离子部分水解,溶液显示酸性,则:c(H+)>c(OH+)、c(Na+)=c(SO42-)>c(NH4+),溶液中离子浓度大小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH+),故B正确;
C.25℃时,pH=3的硫酸溶液中氢离子浓度为0.001mol/L,pH=11的氨水溶液中氢氧根离子浓度为0.001mol/L,两溶液中氢离子、氢氧根离子浓度相等,则二者对水的电离程度的抑制程度相同,故C错误;
D.等浓度的NaCl和CH3COONa等体积混合,醋酸根离子部分水解,溶液显示碱性,由于醋酸根离子的水解程度较小,则c(CH3COO-)>>c(OH-),所以混合溶液中离子浓度大小为:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选B.
点评 本题考查了离子浓度大小比较、盐的水解平衡常数及其应用、水的电离及其影响等知识,题目难度中等,试题知识点较多,侧重考查学生的分析、理解能力,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
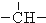 、
、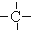 .如某烷烃分子中同时存在这四种基团,-CH2-、
.如某烷烃分子中同时存在这四种基团,-CH2-、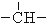 、
、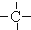 分别为m、n、a个,则该烷烃中-CH3的数目应是( )
分别为m、n、a个,则该烷烃中-CH3的数目应是( )| A. | 2m+3n+4a | B. | m+2n+2a | C. | n+2a+2 | D. | m+n+2a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块在乙醇的液面上游动 | B. | 钠块并不熔化 | ||
| C. | 钠块沉在乙醇液面下面 | D. | 钠块表面有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Cl->F->Na+ | B. | 热稳定性:HCl>H2S>HF | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 熔点:金刚石>晶体硅>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①③④ | B. | 仅②③④ | C. | 仅①③④⑤ | D. | 仅①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:丙烷>乙二醇>乙醇 | |
| B. | 可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 | |
| C. | 油脂和蛋白质均为能发生水解反应的高分子化合物 | |
| D. | 聚碳酸酯 中含有 中含有 结构 结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com