
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.合成纤维和光导纤维都是新型无机非金属材料
B.4.0g NaOH固体中所含分子数为0.1NA(NA表示阿伏加德罗常数的值)
C.纯碱、烧碱、漂白粉都属于盐类
D.Cl2使湿的红色布条褪色是因为HClO有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列有关实验装置进行相应实验,错误的是( )
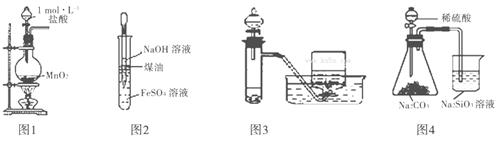
A.用图1所示装置实验室制取少量Cl2
B.用图2所示装置制取及观察Fe(OH)2
C.用图3所示装置用H2O2溶液制备O2
D.用图4所示装置比较S、C、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+ O2(g)==== SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是_________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)====NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)= ===N2(g)+
===N2(g)+ 2C
2C O2(g) ΔH=-bkJ·
O2(g) ΔH=-bkJ· mol-1(b>0)
mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)====4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g )====2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
)====2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2整个过程中放出的热量为867 kJ,则ΔH2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的说法错误的是( )
A.热稳定性:HCl>HI B.原子半径:Na>Mg
C.酸性: H2SO3>H2SO4 D.结合质子能力:S2->Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
| X | Y | ||
| Z | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热
条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液洗后得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素在周期表中的位置是________。
(2)组成单质B的 元素的原子结构示意图为________。
元素的原子结构示意图为________。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,该反应的氧化剂为________。
(4)溶液F在空气中长期放置生成H的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(5)H的溶液与稀硫酸反应产生的现象为____________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
|
| A. | 向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN﹣⇌Fe(SCN)3↓ |
|
| B. | 向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O |
|
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓ |
|
| D. | 用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com