
 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.分析 (1)①根据反应物与生成物总能量大小判断反应吸放热,反应热△H=反应物的活化能-生成物的活化能;
②加入催化剂能降低反应的活化能;
(2)根据热化学方程式的含义以及书写方法来回答;
(3)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ•mol-1
依据盖斯定律①-②计算.
解答 解:(1)①由图象可知该反应是一个能量降低的反应,所以属于放热反应;反应热△H=反应物的活化能-生成物的活化能=E1-E2;
故答案为:放热;E1-E2;
②加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2均减小,故答案为:减小;减小;
(2)因1g丙烷完全燃烧生成液态水时放出50.45kJ的热量,所以44g丙烷完全燃烧生成液态水,放出热量2219.8KJ,
则丙烷完全燃烧的热化学方程式:C3H8(g)+5O2(g )→3CO2(g )+4H2O(l)△H=-2219.8KJ/mol,
故答案为:C3H8(g)+5O2(g )→3CO2(g )+4H2O(l)△H=-2219.8KJ/mol;
(3)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ•mol-1
依据盖斯定律①-②得到C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol
故答案为:+124.2.
点评 本题考查反应热的判断、热化学方程式和盖斯定律计算应用,注意把握反应热的计算方法、热化学方程式的书写方法以及盖斯定律的含义,掌握基础是关键,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
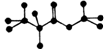
| A. | 该物质在酸性条件下水解生成乙酸 | |
| B. | 该物质含有双键,能跟氢气发生加成反应 | |
| C. | 该物质属于酯类 | |
| D. | 分子式为C3H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反应的平衡常数小于乙 | |
| B. | 该温度下,该反应的平衡常数K为400 | |
| C. | SO2的平衡转化率:α1>α2=α3 | |
| D. | 容器中SO3的物质的量浓度:丙=丁<甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何物质所含有的原子数都相同 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg C中所含有的碳原子数目为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
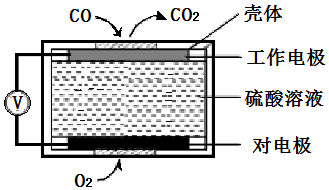
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
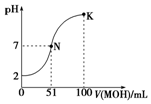 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.
腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题. .腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质.
.腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com