
【题目】在密闭容器中加入0.lmolSi及0.3molHCl,加热发生反应:![]() 测得SiHCl3的平衡产率与温度及压强的关系如下图所示:
测得SiHCl3的平衡产率与温度及压强的关系如下图所示:
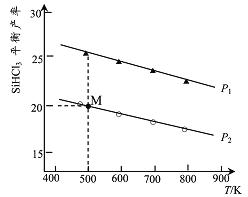
下列说法正确的是
A. 图中P1<P2
B. M点HC1的转化率为10%
C. 平衡时,容器中再加入少量单质Si,HCl的转化率增大
D. 向恒压容器中加入0.2molSi、0.6molHCl,500K、压强为P1时,SiHCl3的平衡产率等于20%
【答案】D
【解析】A、正反应体积减小,增大压强平衡向正反应方向移动,产率增大,则P1>P2,选项A错误;B、M点产率是0.2,则根据方程式可知
Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g)
SiHCl3(g)+H2(g)
起始量(mol) 0.1 0.3 0 0
转化量(mol) 0.02 0.06 0.02 0.02
平衡量(mol) 0.08 0.24 0.02 0.02
所以HCl的转化率为20%,选项B错误;C、硅是固体,平衡时,容器中再加入少量单质硅,平衡不移动,氯化氢的转化率不变,选项C错误;D、向恒压容器中加入0.2molSi、0.6molHCl,500K、压强为P2时平衡等效,所以SiHCl3的平衡产率等于20%,选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标况)氢气,原混合物的质量可能是( )
A. 2 g B. 1 g C. 8 g D. 10 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别装有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且乙的密度大于甲的密度,下列说法正确的( )
A. 甲的分子数比乙的分子数多 B. 甲的摩尔体积比乙的摩尔体积小
C. 甲的物质的量比乙的物质的量少 D. 甲的相对分子质量比乙的相对分子质量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2A+B![]() 3C的化学反应速率,其中表示该反应进行得最快的是
3C的化学反应速率,其中表示该反应进行得最快的是
A. v(A)=0.4mol/(L·s) B. v(B)=0.lmol/(L ·s)
C. v(C)=0.3mol/(L·s) D. v(A)=0.3mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图示表示物质X、Y、Z、W在一定条件下可以按照箭头一步转化。
序号 | X | Y | Z | W |
|
(1) | |||||
(2) |
|
| |||
(3) |
|
|
(1)X是金属单质,焰色反应呈黄色;Y的纯净物易潮解;Z可用于治疗胃酸过多;X在黄绿色的气体中燃烧可以产生白烟W(已知:电解熔融态的W可以得到X)。
X是:___________Y是:___________Z是:__________W是:__________(填写化学式)
(2)Z具有漂白性,但是不稳定,易分解产生含氯化合物。Z是:________(填写化学式)
(3)鉴别X、Y可以滴加___________溶液,前者出现血红色。(填写名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于![]() g B. 二氧化碳的摩尔质量是44 g
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚(DME)-种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al203):2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:

则△H2=____。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的____(填正、负)极,通DME的电极反应为
Ⅱ.2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ/mol(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为

①________________________

(2)T=673K,合成氨反应的热化学方程式为______________
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3 ![]() NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4C1类似。写出盐酸肼第一步水解反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据如下:
3![]() +8HNO3—→3
+8HNO3—→3![]() +8NO↑+7H2O
+8NO↑+7H2O
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 0.962 g/cm3 | 25.9℃ | 160.8℃ | 20℃时,在水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 1.360 g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g。易溶于乙醇,不溶于苯 |
步骤Ⅰ:在如右图装置的三颈烧瓶中加入16 mL 50%的硝酸,再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。

步骤Ⅱ:水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
步骤Ⅲ:当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
步骤Ⅳ:趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后抽滤、洗涤、干燥、称重。
请回答下列问题:
(1)装置b的名称为____;滴液漏斗的细支管a的作用是____。
(2)NaOH溶液的作用为____;实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,目的是____。
(3)抽滤操作结束时先后进行的操作是______。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水或____洗涤晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com