
| A. | Ca(HCO3)2溶液与少量Ca(OH)2溶液反应:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
分析 A.碳酸氢钙过量,反应后不会剩余碳酸根离子;
B.次氯酸具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子;
C.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
D.氨水与二氧化硫反应生成亚硫酸铵和水.
解答 解:A.Ca(HCO3)2溶液与少量Ca(OH)2溶液反应生成碳酸钙沉淀和水,反应的离子方程式为:HCO3-+Ca2++OH-═CaCO3↓+H2O,故A错误;
B.向NaClO溶液中通入少量SO2,二者发生氧化还原反应,正确的离子方程式为:ClO-+H2O+SO2═SO42-+2H++Cl-,故B错误;
C.Cl2通入水中生成次氯酸和HCl,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故C错误;
D.过量氨水吸收工业尾气中的SO2,反应的离子方程式为:2NH3•H2O+SO2═2NH4++SO32-+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于硝酸:H++OH-═H2O | |
| C. | 在NH4Cl溶液中加入NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| D. | 在NH4HCO3溶液中加入足量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
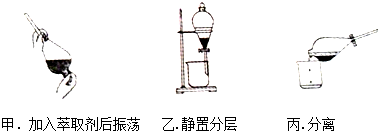 某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:
某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别滴加相同物质的量浓度的盐酸,产生CO2的速率:Na2CO3<NaHCO3 | |
| B. | 分别配成溶液,再加入澄清石灰水,无白色沉淀生成的是NaHCO3 | |
| C. | 分别加热两种样品,没有残留物质的是NaHCO3 | |
| D. | 二者在一定条件下不能相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中通入少量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO32-+H2SiO3 | |
| B. | 饱和石灰水中通入过量二氧化碳:Ca(OH)2+2CO2═Ca2++2HCO3- | |
| C. | 向KI溶液中滴入稀硫酸,并且在空气中充分振荡:4H++4I-+O2═2I2+2H2O | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
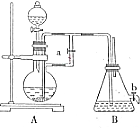 如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的须色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的须色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com