
(16分)中学化学常见的物质A、B、C、D之间存在如下转化关系:A + B →C+D + H2O(没
有配平)请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体。C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:______________________,鉴别这两种气体不能选用的试剂是___________。
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL 2mol?L-1的NaOH溶液中通入0.8mol无色无味的C气体,恰好反应完全,此时反应混合液中物质的量最大的微粒是 ;此时溶液中的阴离子按照浓度由大到小排列的顺序是______。
(2)若A与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成红棕色,将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因_______________________________。
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质,C是漂白粉的有效成分之一,C发生水解反应的离子方程式是______________________________。
(1)C + 2H2SO4(浓)△CO2↑ + 2SO2↑ + 2H2O (3分) a(2分) n(H2O)(2分)
c(HCO3-)>c(CO3 2- )>c(OH-)(2分) (2)2NO2(g) N2O4(g) △H<0(2分)
N2O4(g) △H<0(2分)
降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅 (2分)
(3)ClO-+H2O HClO+OH- (3分)
HClO+OH- (3分)
【解析】
试题分析:(1)C、D两种气体均能使澄清石灰水变浑浊,为SO2、CO2,A为短周期组成的黑色固体物质,与B的浓溶液共热时,产生SO2、CO2两种气体,同时生成水,A为C单质,B为浓硫酸,符合转化关系;碳与浓硫酸在加热的条件下生成SO2、CO2、水,反应方程式为:C + 2H2SO4(浓)△CO2↑ + 2SO2↑ + 2H2O。 a、SO2、CO2都不能与氯化钡溶液反应,无法区别,故a错误;b、SO2能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾褪色,CO2不能反应,可以鉴别,故b正确;c、SO2能品红溶液褪色,CO2不能使品红溶液褪色,可以鉴别,故c正确;d、酸化的硝酸钡溶液通入SO2,可以氧化亚硫酸钡为硫酸钡,产生白色沉淀,通入CO2不反应,可以鉴别,故d正确;故A不能鉴别;CO2的物质的量0.8mol,500mL2mol/L NaOH的水溶液中n(NaOH)=0.5L×2mol/L=1mol,n(CO2):n(NaOH)=0.8mol:1mol=2:3=1:1.25,介于1:1与1:2之间,故反应生成碳酸钠与碳酸氢钠,令碳酸钠与碳酸氢钠的物质的量分别为amol、bmol,由钠离子守恒有2a+b=1,由碳元素守恒有a+b=0.8,联立方程,解得a=0.2,b=0.6,反应离子方程式为:4CO2+5OH-=CO32-+3HCO3-+2H2O;碳酸根、碳酸氢根水解,溶液呈碱性c(OH-)>c(H+),碳酸根的水解程度比碳酸氢根的大,但水解程度很小,故c(HCO3-)>c(CO32-),c(CO32-)原大于c(OH-),溶液中钠离子难度最大,但此反应混合液中物质的量最大的微粒是水,溶液中的阴离子按照浓度由大到小排列的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)。
(2)若A与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成红棕色,说明C是NO,红棕色气体是NO2。二氧化氮与四氧化二氮存在平衡关系2NO2(g) N2O4(g) △H<0,正方应是放热反应,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅。
N2O4(g) △H<0,正方应是放热反应,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅。
(3)若A在水中的溶解度随温度升高而降低,考虑A为Ca(OH)2,B为短周期非金属单质,D是漂白粉的成分之一,B为Cl2,符合转化关系与题意,D能发生水解故D为Ca(ClO)2,Ca(ClO)2发生水解的离子方程式为:ClO-+H2O HClO+OH-。
HClO+OH-。
考点:考查无机框图题的推断


科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:填空题
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
A. NH4Cl晶体 B. Na3AlF6晶体 C. Na2CO3?10H2O晶体
D. CuSO4溶液 E. CH3COOH溶液
(4)部分共价键键能数据如下表:
键 | H-H | N-H | N-N | N=N | N≡N |
键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式: 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
在100 mL某混合酸中,c(HNO3)=0.4 mol·L-1,c(H2SO4)=0.1 mol·L-1,向其中加入1.92 g铜粉,待充分反应后,忽略溶液体积的变化,溶液中Cu2+的物质的量浓度为( )
A.0.15 mol·L-1 B.0.30 mol·L-1 C.0.225 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列措施不符合节能减排的是
A.大力发展火力发电,解决城市电力紧张问题
B.在屋顶安装太阳能热水器,为居民提供生活用热水
C.尽量少开私家车,多骑自行车。
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:选择题
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )

A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X>Z>M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:简答题
(15分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
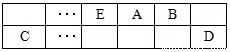
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
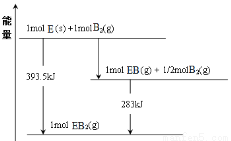
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。
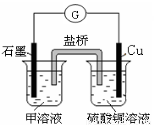
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:填空题
[物质结构与性质,13分]
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式 。
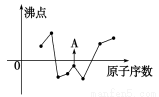
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
键长/(pm) | B—F | B—Cl | B—Br |
计算值 | 152 | 187 | 199 |
实测值 | 130 | 175 | 187 |
(3)三氟化硼分子的空间构型是 ;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如右表。硼卤键长实测值比计算值要短得多,可能的原因是 。
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
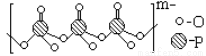
①磷原子的杂化类型为 。
②这种多聚磷酸钠的化学式为 。
(5)已知HF与F-通过氢键结合成HF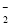 。判断HF
。判断HF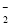 和HF
和HF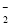 微粒间能否形成氢键,并说明理由。
微粒间能否形成氢键,并说明理由。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com