
铁、铜及其化合物有广泛应用,请回答下列问题:
(1)①钢铁的电化腐蚀简单示意图如下图一所示,在该图虚线框内稍作修改,即可成为钢铁电化学防护的简单示意图,请在下图虚线框内做出修改,并用箭头标出电子流动方向。

②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式:
。
(2)如要用图二装置电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
① X电极的电极反应式是 ,② Y电极的材料是 。
(3)若用图二装置电解200mL 1mol·L-1 的AgNO3溶液(X、Y为惰性电极),当阴极质量增加2.16g时,则被电解溶液的pH为 (溶液体积变化忽略不计)。
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
下列对Ⅰ~Ⅳ实验的现象预测正确的是
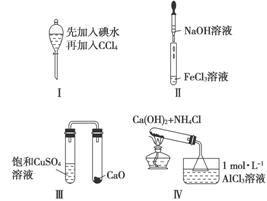
A.实验Ⅰ:振荡后静置,液体分层,下层液体无色
B.实验Ⅱ:滴入氢氧化钠溶液后,试管中出现白色沉淀迅速变为灰绿色最后变为红褐色
C.实验Ⅲ:一段时间后,饱和CuSO4溶液中出现蓝色晶体
D.实验Ⅳ:加热后,水槽中先生成白色沉淀,后逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是:
A.异戊二烯CH2=C(CH3)CH=CH2与等物质的量的Br2发生加成反应
B.2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
肯定属于同族元素且性质相似的是:( )
A.原子核外电子排布式:A为1s22s2,B为1s2
B.结构示意图:A为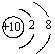 ,B为
,B为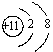
C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D.A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:( )
A、非金属元素间形成的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、只有非金属原子间才能形成共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应能量变化的说法中正确的是( )
A.凡需要加热的化学反应一定是吸热反应
B.酸碱中和反应,燃烧反应一定是放热反应
C.使用催化剂的化学反应一定是吸热反应
D.氧化还原反应和化合反应一定是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在碱性溶液中大量共存,且溶液呈无色透明的是( )
A.K+、MnO 、Cl-、SO
、Cl-、SO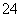
B.Na+、Cl-、H+、ClO-
C.Na+、AlO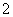 、NO
、NO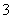 、CO
、CO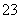
D.Na+、SO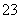 、HCO
、HCO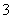 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.羟基跟链烃基直接相连的化合物属于醇类
B.分子中含有羟基的化合物属于醇类
C.酚类和醇类具有相同的官能团,因而具有相同的化学性质
D.分子内含有苯环和羟基的化合物都属于酚类
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)===2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)===2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
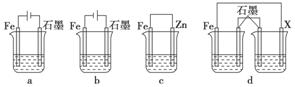
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a、b、c装置中能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
(5)25 ℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39。25 ℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com