
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
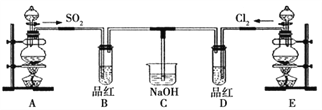
(1)实验室用装置A制备SO2。从物质类别看,SO2属于________(填“酸性”、“两性”或“碱性”)氧化物;
(2)实验室用装置E制备Cl2,写出该反应的离子方程式:___________________________。当有0.2 mol电子转移时,产生氯气的体积(标准状况)是________,氧化剂与还原剂的物质的量之比是________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________________,D:________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1︰1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________________________。
(5)有人预测SO2能使酸性高锰酸钾溶液褪色,你认为该预测是否合理?________(填“合理”或“不合理”),理由是________________________________________________。
【答案】 酸性 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2.24 L 1∶2 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O=2HCl+H2SO4 合理 SO2具有还原性,KMnO4具有强氧化性,SO2可将KMnO4还原,溶液变为无色
Mn2++Cl2↑+2H2O 2.24 L 1∶2 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O=2HCl+H2SO4 合理 SO2具有还原性,KMnO4具有强氧化性,SO2可将KMnO4还原,溶液变为无色
【解析】分析:(1)根据二氧化硫的性质分析分析;
(2)实验室利用浓盐酸与二氧化锰加热制备氯气;根据氧化还原反应的有关概念和电子得失守恒计算;
(3)根据二氧化硫的漂白不稳定,氯气溶于水生成的次氯酸具有强氧化性,其漂白是不可逆的解答;
(4)根据氯气能氧化二氧化硫分析;
(5)根据二氧化硫具有还原性分析。
详解:(1)二氧化硫能与碱反应生成盐和水,因此二氧化硫是酸性氧化物;
(2)实验室用装置E制备Cl2,反应需要加热,说明反应物是二氧化锰和浓盐酸,该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。反应中氯元素化合价从-1价升高到0价,失去1个电子,即得到1mol氯气转移2mol电子,所以当有0.2 mol电子转移时,产生氯气的体积(标准状况)是0.1mol×22.4L/mol=2.24L;二氧化锰是氧化剂,氯化氢是还原剂,4mol氯化氢参加反应有2mol是还原剂,则氧化剂与还原剂的物质的量之比是1∶2。
Mn2++Cl2↑+2H2O。反应中氯元素化合价从-1价升高到0价,失去1个电子,即得到1mol氯气转移2mol电子,所以当有0.2 mol电子转移时,产生氯气的体积(标准状况)是0.1mol×22.4L/mol=2.24L;二氧化锰是氧化剂,氯化氢是还原剂,4mol氯化氢参加反应有2mol是还原剂,则氧化剂与还原剂的物质的量之比是1∶2。
(3)二氧化硫的漂白是与有色物质化合生成不稳定的无色物质,漂白是不稳定的,氯气溶于水生成的次氯酸具有强氧化性,其漂白是不可逆的,因此停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B中褪色的品红又恢复成红色,D中无明显现象。
(4)氯气具有强氧化性,能把二氧化硫氧化为硫酸,从而失去漂白性,所以将制得的SO2和Cl2按1︰1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样,反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4。
(5)由于SO2具有还原性,KMnO4具有强氧化性,SO2可将KMnO4还原,溶液变为无色,因此SO2能使酸性高锰酸钾溶液褪色。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列有关说法错误的是
A. 氧化性:Cr2O72->Fe3+>SO2
B. K2Cr2O7能将Na2SO3氧化成Na2SO4
C. 每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D. 若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C. 铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
D. 硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
A.苏打﹣NaHCO3
B.胆矾﹣CuSO4
C.酒精﹣C2H5OH
D.生石灰﹣Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)工业上利用CO2与NH3混合,在一定条件下反应合成尿素: 2NH3(g)+CO2(g) ![]() CO(NH2)2(S)+H2O(g)△H
CO(NH2)2(S)+H2O(g)△H
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 .
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)正 d.容器中氨气的浓度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂. ZnSO4受热分解过程中各物质物质的量随温度变化关系如图1所示. 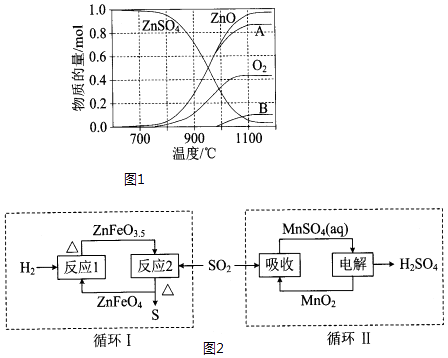
①写出700℃~980℃时发生反应的化学方程式: , 物质B的化学式是 . (A、B均为硫的氧化物)
②硫酸锌分解生成的SO2经图2中的两个循环可分别得到S和H2SO4 . 写出循环I中反应2的化学方程式:;循环II中用惰性电极电解,阳极反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是( )
A.乙酸的结构简式:C2H4O2
B.乙烯的电子式: ![]()
C.硫离子结构示意图: ![]()
D.氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH﹣)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,w溶液可使酚酞溶液显红色。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小:a<b<c<d
B. x的电子式一定是:![]()
C. 氢化物的沸点:b>d
D. y、w含有的化学键类型完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com