

| A.装置①可用于分离互不相溶的液体 |
| B.装置②可用于实验室配置一定物质的量浓度溶液 |
| C.装置③可用于验证醋酸、碳酸、苯酚的酸性强弱 |
| D.装置④可用于实验室制备少量氨气 |
科目:高中化学 来源:不详 题型:单选题
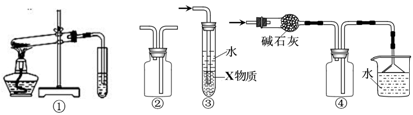
| A.装置①可用于探究NH4HCO3的热稳定性 |
| B.装置②可用于收集H2、CO2 |
| C.装置③中X若为CCl4,可用于吸收氨气或氯化氢,并能防倒吸 |
| D.装置④可用于干燥、收集NH3,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
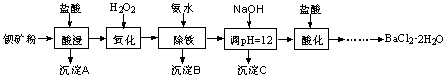
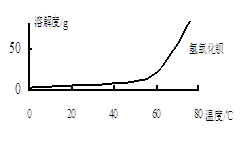

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
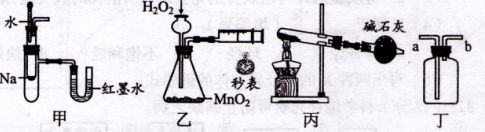
| A.装置甲可用于验证反应的热效应 |
| B.装置乙可定量测定化学反应的速率 |
| C.装置丙可用于实验室以NH4Cl为原料制备少量NH3 |
| D.装置丁a口进气可收集NH3、C12等气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.清洗做完焰色反应的铂丝——稀盐酸 |
| B.干燥CO气体——浓硫酸 |
| C.洗去附着在试管内壁的硫——热NaOH溶液 |
| D.洗去附着在试管内壁的氯化银——稀硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

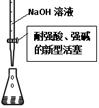
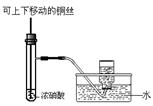
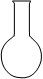
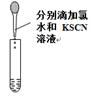
| A.用①量取15.00 mL NaOH溶液 |
| B.用②制备并收集少量NO2气体 |
| C.用③所示的仪器配制1L 0.1000mol/LNaCl溶液 |
| D.用④进行Fe2+的检验 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 [Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com