
| A. | CH4、C2H4 | B. | CH4、C2H5OH | C. | C2H6、C3H8 | D. | CH3CHO、C3H8 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,所谓的结构相似,即必须属于同一类物质,具有相同的通式,据此分析.
解答 解:A、CH4为甲烷,属于烷烃,而C2H4为乙烯,属于烯烃,两者结构不相似,不是同系物,故A错误;
B、CH4为甲烷,属于烷烃,C2H5OH为乙醇,属于醇类,两者结构不相似,不是同系物,故B错误;
C、C2H6为乙烷,C3H8为丙烷,均属于烷烃,两者结构相似,且在分子组成上相差一个CH2原子团,故互为同系物,故C正确;
D、CH3CHO为乙醛,为醛类,C3H8而为丙烷,均属于烷烃,两者结构不相似,不属于同系物,故D错误.
故选C.
点评 本题考查了同系物的判断,应根据同系物的概念来分析,即同系物必须属于同一类物质,具有相同的通式,且在分子组成上相差一个或若干个CH2原子团,难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  向一定量的饱和石灰水中加入氧化钙 | |
| B. |  加热一定量高锰酸钾固体产生氧气 | |
| C. |  用一定量的双氧水制取氧气 | |
| D. |  向一定量的硝酸银溶液中插入铜丝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
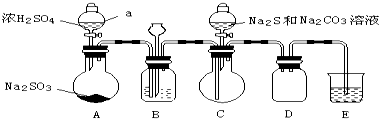
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3 Na2S, 一定不含有Na2SO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与氧化铁高温下发生反应 | D. | 将锌粒投入FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com