
分析 (1)室温下水的离子积为1×10-14;
(2)强酸溶液稀释,氢离子浓度随体积增大呈比例减小;而氯化铵溶液稀释促进铵根离子的水解,水解出更多氢离子,故氢离子浓度下降较慢;
(3)氯化铵水解过程是吸热反应,加热溶液,促进水解氢离子浓度变大,硫酸溶液加热,氢离子浓度基本不变;
(4)硫酸中的氢氧根离子是水电离的,氯化铵溶液中的氢离子是水电离的,据此进行计算;
解答 解:(1)室温下两溶液中水的离子积Kw=c(H+)•c(OH-)=1×10-14,与溶液的种类无关.故答案为:1×10-14;
(2)室温的条件下,pH均为3的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加水稀释至50mL,稀释10倍,硫酸溶液pH变为4;而氯化铵溶液中铵根离子水解促进,水解出更多的氢离子,故溶液中氢离子浓度减小的少,溶液pH小于4,即pH较大的是硫酸溶液;
故答案为:H2SO4;
(3)室温的条件下,pH均为3的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加热到90℃,由于硫酸是强电解质,以及完全电离,故加热后硫酸溶液中氢离子浓度不变,即pH不变;由于氯化铵的水解是吸热反应,加热促进水解,故水解出更多氢离子,导致氢离子浓度增大,故溶液pH变小.
故答案为:NH4Cl;
(4)室温的条件下,pH均为3的H2SO4溶液和NH4Cl溶液中存在离子积常数,硫酸溶液中,c(H+)酸×c(OH-)水=10-14,则水电离的氢氧根离子的浓度c(OH-)水=1×10-11mol∕L;氯化铵溶液中,c(H+)水×c(OH-)水剩余=10-14,则水电离的氢离子浓度为c(H+)水=1×10-3mol∕L,
故答案为:1×10-11mol∕L;1×10-3mol∕L.
点评 本题考查了盐类水解的应用判断、溶液pH的计算等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理及其影响因素.


科目:高中化学 来源: 题型:解答题
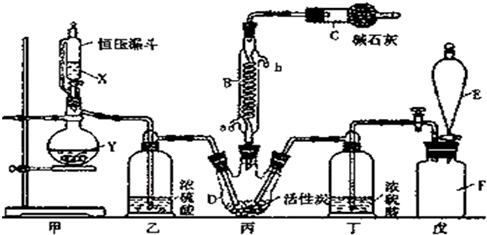
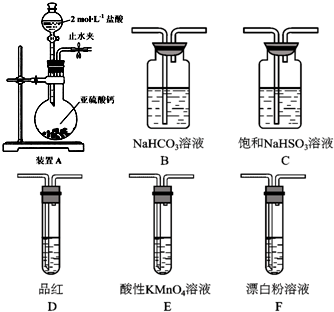
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
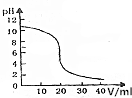 常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )
常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )| A. | V=10.00mL时,c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| B. | V=20.00mL时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | pH=7时,消耗盐酸的体积大于20.00mL | |
| D. | pH=8时,c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| B | 向盛有Fe(NO3)2溶液的试管中加入1mol/LH2SO4 | 若试管口出现红棕色气体,说明NO3-被Fe2+还原为NO |
| C | 淀粉碘化钾溶液久置显蓝色 | 是由于I-被还原,析出的I2溶于溶液中 |
| D | 向含有少量的FeBr3的FeCl3溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl3溶液中的FeBr3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日本的水俣病是由重金属镉污染引起的 | |
| B. | 垃圾处理要遵循无害化、减量化和资源化的原则 | |
| C. | 水体的富营养化是由于水体中植物营养物质过多蓄积而引起的污染 | |
| D. | 污水处理中混凝法、中和法、沉淀法、氧化还原法等都是化学方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:4 | D. | 1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3 | B. | +4 | C. | +5 | D. | +6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com