
| A. | 煤 | B. | 石油 | C. | 天然气 | D. | CO |
科目:高中化学 来源: 题型:解答题
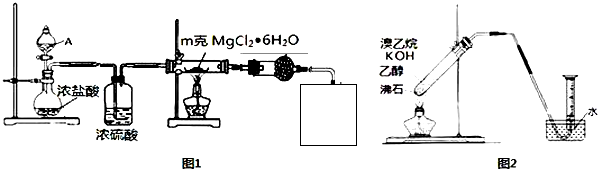
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>rC)>r(B) | |
| C. | 1.0L 0.1mol/L戊溶液中含阴离子总的物质的量小于0.lmol | |
| D. | 1mol甲与足量的乙完全反应共转移约1.204×l024个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 答案 | 实验现象 |
| (1)将浓硫酸滴在小木条上 | A.产生白烟 | |
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 | B.溶液褪色 | |
| (3)在盛有KI淀粉溶液的试管中滴加氯水 | C.溶液呈红色 | |
| (4)在盛有FeCl3溶液的试管中滴入2滴KSCN溶液 | D.产生棕红色气体 | |
| (5)铜丝放到浓硝酸中 | E.变黑色 | |
| (6)铜丝放入热的浓硫酸溶液中,将生成气体通入品红溶液中 | F.产生蓝色物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4 | |
| D. | 熔点:SiO2>NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
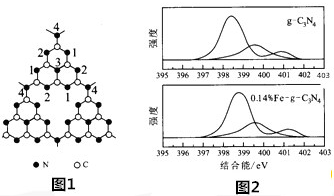 g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/mol•L-1 | 6 | 3 | 2 | 2 |
| c(B)/mol•L-1 | 5 | 3.5 | 3 | 3 |
| c(C)/mol•L-1 | 1 | 2.5 | 3 | 3 |
| A. | 在容器中发生的反应为2A+B?2C | |
| B. | 该温度下,此反应的平衡常数为0.25 | |
| C. | A的平衡转化率比B的平衡转化率低 | |
| D. | 起始加入的A、B物质的量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com