
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
科目:高中化学 来源: 题型:解答题
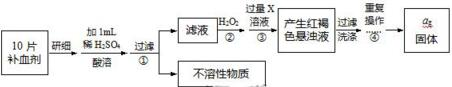
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,冷却水应从冷凝管的上端进入 | |
| B. | 分液时,应把下层液体从下端放出后,再把上层液体从下端放出 | |
| C. | 过滤时,漏斗的下端应紧贴烧杯内壁 | |
| D. | 萃取时,所选的萃取剂的密度应比原溶液的密度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.
非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
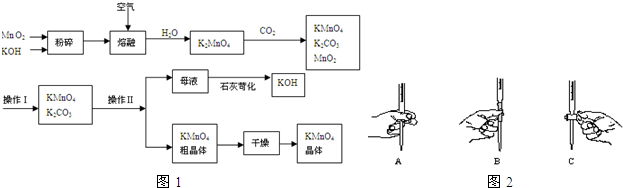
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com