
【题目】工业生产硝酸铵的流程如下图所示:
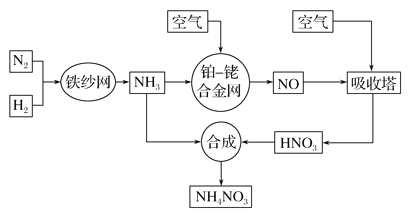
请回答下列问题:
(1)已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1。
2NH3(g) ΔH=-92.4 kJ· mol-1。
①在500 ℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量________(填“大于”、“小于”或“等于”)92.4 kJ。
②为提高H2的转化率,实际生产中宜采取的措施有________(填字母)。
A.降低温度
B.最适合催化剂活性的适当高温
C.适当增大压强
D.减小压强
E.循环利用和不断补充氮气
F.及时移出氨
(2)该流程中铂—铑合金网上的氧化还原反应为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。
①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K________(填“增大”、“减小”或“不变”),理由是__________________________________________________________________。
②若其他条件不变,则下列图像正确的是________(填字母)。

【答案】 小于 CEF 减小 氨的催化氧化反应是放热反应,升高温度,平衡逆向移动,K会减小 ABC
【解析】(1)①在1.01×105kPa和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,所以放出的热量小于92.4kJ;②N2(g)+3H2(g)2NH3(g)△H=-92.4 kJ/mol,该反应正反应为体积缩小的反应,A.降低温度,反应速率降低,不选用;B.最适合催化剂活性的适当高温,催化剂对平衡没有影响,不选;C.适当增大压强,平衡正向移动;可选;D.减小压强,平衡逆向移动,不选;E.循环利用和不断补充氮气,提高H2的转化率,可选;F.及时移出氨平衡正向移动;故选CEF。(2)①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K减小,氨的催化氧化反应是放热反应,升高温度,平衡逆向移动,K会减小;②A、增大压强平衡逆移,所以压强越大NH3的转化率越小,与图象相符,故A正确;B、加催化剂不改变平衡,所以O2的含量不变,反应速率增大,到达平衡的时间变小,与图象相符,故B正确;C、增大压强平衡逆移,所以压强越大NO越小,与图象相符,故C正确;D、升高温度,平衡逆向移动,H2O的含量降低,与图象不符,故选ABC。


科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键 B. 冰.水和水蒸气中都存在氢键
C. 分子间形成的氢键使物质的熔点和沸点升高 D. H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能被酸性高锰酸钾溶液氧化成CO2。既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是
A.通入足量溴水中B.在空气中燃烧
C.通入酸性高锰酸钾溶液中D.通入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
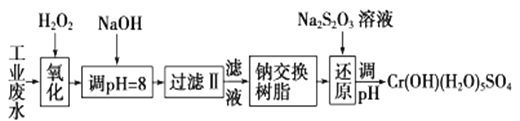
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.HNO3 B.Na2O2 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________(填ABCD序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________(填ABCD序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
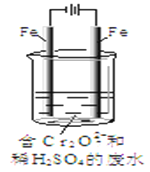
(3)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(4)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 体积相等的CO和N2质量一定相等
B. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 N A
C. 用过量NaOH溶液吸收 CO2的离子方程式:OH-+CO2= HCO3-
D. NaHSO4溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀时溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C三种可溶性化合物,它们的阳离子可能是Na+、Mg2+、Ag+,阴离子可能是NO3-、OH-、Cl-,分别取相同质量的三种化合物,溶解于水,配制相同体积的溶液, 其物质的量的浓度由大到小的顺序是A、B、C,则三种化合物化学式分别是:A______、B______、C_________________。
(2)有以下3种物质:①Na2CO3固体②Fe(OH)3胶体③硫化锑(Sb2S3)胶体
填空回答:
A.①既是钠盐又是碳酸盐,对该物质的分类方法是___________________________。
B.实验室制备②的化学方程式为_____________________________________。
C.橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带_____电荷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. 分子式为C4H10的二氯取代物的同分异构体有8种
B. 相对分子质量相差14或14的整数倍的有机物互为同系物
C. 1mol有机物 最多可与5molH2发生加成反应
最多可与5molH2发生加成反应
D. 用氯乙烯制聚氯乙烯的原子利用率为100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com