
【题目】在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体牛成,将气体通人澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )
A.Cl-,S042-
B.Cl-,NO3-
C.Cl-,CO32-
D.Cl-,OH-
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO![]() +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol·L-1KMnO4溶液与2mL0.01mol·L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol·L-1KMnO4溶液与2mL0.01mol·L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | |
Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
Ⅲ | 2 | 30 | |
Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是_______;如果研究温度对化学反应速率的影响,使用实验Ⅰ和___________(Ⅰ~Ⅳ表示)。
(3)实验Ⅳ中加入1 mL蒸馏水的目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量xAl2(SO4)3y(NH4)2SO424H2O晶体加入到过量NaOH溶液中,加热生成NH3 0.85g(假如生成的NH3全部逸出),再通入过量的CO2,过滤、洗涤、灼烧,得Al2O3固体2.55g.则x:y=(已知:Al2O3的相对分子质量为102;NH3的相对分子质量为17)( )
A. 1:2 B. 1:1 C. 1:4 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中会产生大带含铬废水,需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72- 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
① 写出NaHSO3与Cr2O72-反应的离子方程式:__________________________________。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31。若除去废水中Cr3+,使其浓度小于1×10-5 molL-1,此时溶液中的c(H+)<_________molL-1
(2)废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应后生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+ ![]() Cr2O72-
Cr2O72- ![]() I2
I2 ![]() S4O62-
S4O62-
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会________(选填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 molL-1的Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示),写出计算过程。_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小, Y的次外层电子数是最外层的![]() ,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
A. 原子半径:rW>rZ>rY
B. 化合物ZX中各原子均满足8电子稳定结构
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 简单气态氢化物稳定性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是
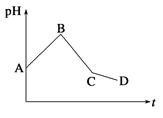
A.阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2
B.AB段阳极只产生Cl2,阴极只产生Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段相当于电解水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是( )

A. 实验Ⅰ:实验室制备氨气 B. 实验Ⅱ:用二氧化碳作喷泉实验
C. 实验Ⅲ:进行中和热的测定 D. 实验Ⅳ:电解氯化铜溶液得到铜和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:SO32-+I2+H2O= SO42-+2I-+2H+。某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,下列关于溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32 - ④可能含有I-
A. ①③ B. ①②③ C. ①② D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是
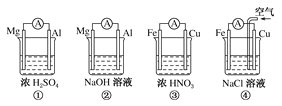
A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com