
| A. | 工业制漂白粉:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 将氯气溶于水制备次氯酸:C12+H2O═2H++Cl-+ClO- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
分析 A.工业上用石灰乳与氯气反应制取漂白粉,氢氧化钙不能拆开;
B.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
C.氯化铁与铜反应生成氯化亚铁和氯化铜;
D.酸性条件下高锰酸钾能够将HCl氧化成氯气,干扰了检验结果.
解答 解:A.工业上用石灰乳与氯气反应制取漂白粉,石灰乳的中氢氧化钙不能拆开,正确的离子方程式为:Cl2+Ca(OH)2=Cl-+ClO-+H2O+Ca2+,故A错误;
B.将氯气溶于水制备次氯酸,次氯酸不能拆开,正确的离子方程式为:C12+H2O═H++Cl-+HClO,故B错误;
C.用FeCl3溶液腐蚀铜线路板,铁离子与铜反应生成亚铁离子和铜离子,反应的离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,故C正确;
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,酸性高锰酸钾溶液能够氧化氯离子,导致溶液褪色,无法据此证明H2O2具有还原性,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18 g CD4中含有NA个碳原子 | |
| B. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| C. | 4.4g乙醛和丁酸的混合物完全燃烧,消耗氧分子的数目为0.25NA | |
| D. | 100mL浓度为lmol/L的蔗糖溶液中所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
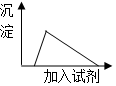
| A. | 该溶液中,Ag+、K+、NH4+、SO42-可以大量共存 | |
| B. | 该溶液中,Na+、OH-、NO3-、CO32-不能大量共存 | |
| C. | 向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 | |
| D. | 向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
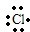 →
→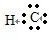
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

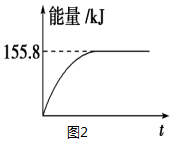
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
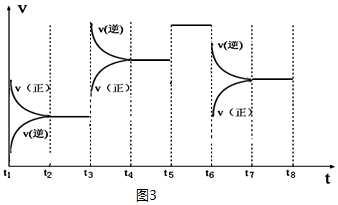
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com