
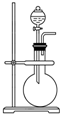
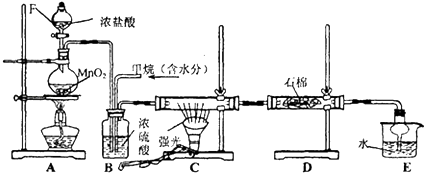
 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.分析 (1)该装置在加入反应物前,先检查装置气密性;
(2)该装置为固液不加热装置,可以用过氧化氢和二氧化锰,或水与过氧化钠反应制备氧气;
(3)用该装置制取NO2,利用Cu与浓硝酸反应制备;
(4)该装置为固液不加热装置,结合气体的制备原理分析.
解答 解:(1)该装置在加入反应物前,为了防止漏气,应首先检查装置气密性,故答案为:检查装置气密性;
(2)该装置为固液不加热装置,可以用二氧化锰催化过氧化氢分解生成氧气,或水与过氧化钠反应生成氢氧化钠和氧气,
故答案为:过氧化氢与二氧化锰(或水与过氧化钠);
(3)用该装置制取NO2,利用Cu与浓硝酸反应制备,反应为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
(4)该装置为固液不加热装置,
a.用锌与稀硫酸反应制备H2 ,可以选用该装置,故a选;
b.用盐酸和石灰石制备CO2 ,可以选用该装置,故b选;
c.用生石灰与浓氨水制备NH3,可以选用该装置,故c选;
d.用稀硫酸与亚硫酸钠反应制备SO2,可以选用该装置,故d选;
故答案为:abcd.
点评 本题考查气体的制备实验,为高频考点,侧重于学生的分析能力、实验能力的考查,把握气体的制备反应原理、实验技能、实验装置的作用为解答的关键,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
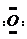 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


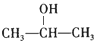 +NaCl;
+NaCl;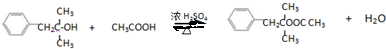 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
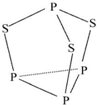 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )| A. | 该物质中磷元素的化合价为+3 | |
| B. | 该物质分子中不含非极性共价键 | |
| C. | 该物质的熔、沸点比P4低 | |
| D. | 该物质22 g含硫原子的数目约为1.806×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
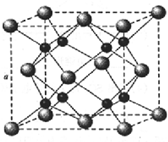 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com