
【题目】已知向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池. 
(1)写出FeCl2与稀硝酸反应的离子方程式 .
(2)图中电子流动方向为极到极.
(3)在乙烧杯中会观察到的现象为 , 写出乙烧杯中的电极反应方程式 .
(4)H+流向烧杯,若一段时间内流向该烧杯的H+有0.05mol,则消耗Fe2+g
(5)该装置存在的缺点可能是(写一点)
(6)若将乙烧杯的稀硝酸换成浓硝酸,写出a电极上的电极反应方程式
【答案】
(1)3Fe2++4H++NO3﹣=3Fe3++NO↑+2H2O
(2)a;b
(3)生成无色气体,遇到空气变红棕色;4H++NO3﹣+3e﹣=NO↑+2H2O
(4)乙;2.8
(5)正极生成的NO会污染空气
(6)Fe2+﹣e﹣=Fe3+
【解析】解:(1)亚铁离子与稀硝酸反应生成NO、铁离子和水,则FeCl2与稀硝酸反应的离子方程式为:3Fe2++4H++NO3﹣=3Fe3++NO↑+2H2O;所以答案是:3Fe2++4H++NO3﹣=3Fe3++NO↑+2H2O;(2)亚铁离子在负极上失电子,则a为负极,b为正极,原电池中电子从负极流向正极,即电子从a极流向b极;
所以答案是:a;b;(3)b为正极,正极上硝酸根离子得电子生成NO,则正极反应式为:4H++NO3﹣+3e﹣=NO↑+2H2O;乙烧杯中硝酸根离子得电子生成NO,NO遇到空气生成二氧化氮,所以生成的无色气体会变为红棕色;
所以答案是:生成无色气体,遇到空气变红棕色;4H++NO3﹣+3e﹣=NO↑+2H2O;(4)原电池中,溶液中阳离子向正极移动,则H+流向乙烧杯,若一段时间内流向该烧杯的H+有0.05mol,则外电路中转移电子为0.05mol,负极电极反应为:Fe2+﹣e﹣=Fe3+ , 则消耗Fe2+为0.05mol,其质量为0.05mol×56g/mol=2.8g;
所以答案是:乙;2.8;(5)正极反应式为:4H++NO3﹣+3e﹣=NO↑+2H2O,正极产物NO为有毒气体,会污染空气;
所以答案是:正极生成的NO会污染空气;(6)乙烧杯的稀硝酸换成浓硝酸,负极上仍然是亚铁离子失电子生成铁离子,则a极上反应式为:Fe2+﹣e﹣=Fe3+;
所以答案是:Fe2+﹣e﹣=Fe3+ .


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期元素.W的气态氢化物能使紫色石蕊溶液变蓝,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,W、X、Y、Z的最外层电子数之和为16.
(1)W单质的电子式是 .
(2)请用化学用语解释W的气态氢化物能使紫色石蕊溶液变蓝的原因: .
(3)已知As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是 .
(4)W的最高价氧化物的水化物与Y的氢氧化物发生反应的离子方程式是
(5)X与Z的单质之间发生反应的化学方程式是 .
(6)已知Q与Z是位于相邻周期的同主族元素.某温度下,两种元素的气态单质与H2发生化合反应生成气态氢化物的平衡常数分别为KQ=5.6×107 , KZ=9.7×1012 . Q的元素符号是 , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于碱金属元素的表述正确的是( )
A. 碱金属是对应周期中金属性最强的元素B. 从上至下单质氧化性逐渐减弱
C. Li、Na、K单质均应保存在煤油中D. Li、Na、K燃烧均生成过氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图的表示方法形象表示,其中●表示质子或电子,○表示中子,则有关①②③的叙述正确的是( ) 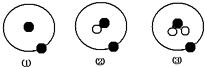
A.①②③是化学性质不同的粒子
B.①不是核素,②③才是核素
C.①②③具有相同的质量数
D.①②③互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是
A. 金属元素的原子只有还原性,离子只有氧化性
B. 含金属元素的离子不一定都是阳离子
C. “真金不怕火炼”是指金的熔点高
D. 金属元素单质在常温下均为固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6 kJmol﹣1氢气的燃烧热为241.8 kJmol﹣1
B.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=﹣57.4 kJmol﹣1 , 则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ/mol的热量
C.已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定
D.己知C(s)+O2(g)=CO2(g);△H1C(s)+1/2O2(g)=CO(g);△H2 , 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的一些问题常涉及到化学知识,下列叙述正确的是( )
A.晶体硅具有半导体的性质,所以可以制作光导纤维
B.燃煤中加入生石灰可以减少二氧化硫的排放
C.明矾和漂白粉常用于自来水的处理,两者的作用原理相同
D.氯化铁溶液可用于制作印刷电路板是因为其具有氧化性,与铜发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硅在自然界中有3种同位素: ![]() 、
、 ![]() Si、
Si、 ![]() .硅的近似相对原子质量为28.1,则
.硅的近似相对原子质量为28.1,则 ![]() 原子在自然界中的百分含量为( )
原子在自然界中的百分含量为( )
A.等于90%
B.大于90%
C.小于90%
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和KCl溶液的密度为1.174gcm﹣3 , 物质的量浓度为4.0molL﹣1 , 则下列说法中不正确的是( )
A.20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0molL﹣1
B.20℃时,将29.8 gKCl溶于87.6g水中可得饱和溶液
C.20℃时,密度小于1.174gcm﹣3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com