
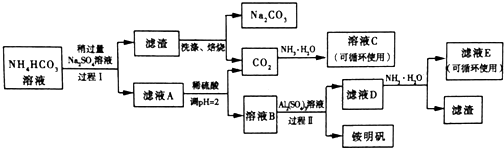
分析 碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾,D主要为剩余的NH4HSO4、Al2(SO4)3,
(1)CO2与氨水反应生成NH4HCO3或(NH4)2CO3,溶液C可以循环使用可以判断为碳酸氢铵;
(2)少量的氨明矾的水溶液滴加到Ba(OH)2溶液中反应,铵明矾中离子全部反应生成一水合氨、硫酸钡和偏铝酸钡,结合电荷守恒和原子守恒配平书写得到离子方程式;
(3)NH4HCO3易受热分解;
(4)在平衡体系中增加一种反应物的浓度,反应正向进行,提高另外反应物的转化率;
(5)A为(NH4)2SO4和剩余的硫酸盐和碳酸盐,B主要为NH4HSO4,D主要为剩余的NH4HSO4、Al2(SO4)3,E为(NH4)2SO4;
(6)明矾铵的溶解度随着温度的升高而增大,故采用降温结晶的方法分离,因滤液浓度低,所以需要浓缩;
解答 解:碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾,D主要为剩余的NH4HSO4、Al2(SO4)3.
(1)CO2与氨水反应生成NH4HCO3或(NH4)2CO3,溶液C可以循环使用可以判断为碳酸氢铵,
故答案为:NH4HCO3;
(2)少量的氨明矾的水溶液滴加到Ba(OH)2溶液中反应,铵明矾中离子全部反应生成一水合氨、硫酸钡和偏铝酸钡,结合电荷守恒和原子守恒配平离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O,
故答案为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O:
(3)NH4HCO3易受热分解,故反应应控制温度不能超过40℃,
故答案为:NH4HCO3易受热分解;
(4)在平衡体系中增加一种反应物的浓度,反应正向进行,提高另外反应物的转化率,HCO32-(aq)+Na+(aq)?NaHCO3(s),Na+浓度增大平衡向正反应方向移,故答案为:HCO32-(aq)+Na+(aq)?NaHCO3(s),Na+浓度增大平衡向正反应方向移动;
(5)A为(NH4)2SO4和剩余的硫酸盐和碳酸盐,B主要为NH4HSO4,D主要为剩余的NH4HSO4、Al2(SO4)3,E为(NH4)2SO4,溶液E中的溶质离子为:NH4+、SO42-,故答案为:NH4+、SO42-;
(6)明矾铵的溶解度随着温度的升高而增大,故采用降温结晶的方法分离,因滤液浓度低,所以需要浓缩,方法为蒸发浓缩、降温结晶(冷却结晶),故答案为:蒸发浓缩;蒸发浓缩,冷却结晶.
点评 本题考查制备实验方案设计、物质组成的测定,明确工艺流程原理是解题关键,综合考查学生分析解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下:I1=738 kJ•mol-1 I2=1451 kJ•mol-1 I3=7733 kJ•mol-1 I4=10540 kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是光照、超声波、压强和催化剂等 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| C. | 可逆反应进行到一定程度时,正、逆反应速率相等.各物质浓度也相等 | |
| D. | 生产过程中,化学反应限度是决定原料利用率和产品产率的重要因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
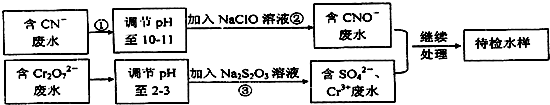
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和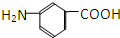 E.35Cl和37Cl
E.35Cl和37Cl ,
, ,该烯烃可能的结构简式有2种.
,该烯烃可能的结构简式有2种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
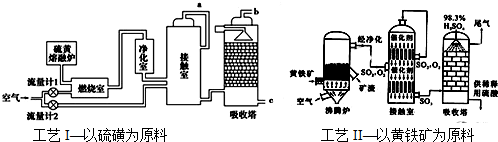
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
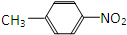
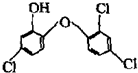 据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )
据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 哥罗芳存在同分异构体 | |
| C. | 1mol三氯生最多能与4molNaOH溶液反应 | |
| D. | 三氯生遇FeCl3溶液显紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com