
科目:高中化学 来源:福建省古田一中2008-2009学年高二下学期第二次月考化学试卷 题型:022
下表为元素周期表的一部分,a、b、c……为部分元素.回答下列问题:
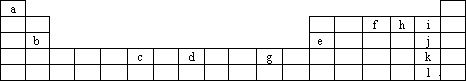
(1)请写出j的单质与a、h形成的化合物发生反应的化学方程式________;
(2)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式________,它是由________键(根据原子轨道的重叠程度填写)形成化合物
(3)①请写出上;
②某元素的原子基述元素c原子的基态电子排布式为:________,该元素的最高正化合价为________态时有6个电子处于3d轨道上,则该元素原子的3d轨道上的未成对电子有________个.
③某元素的基态原子失去3个电子后,它的3d轨道内电子恰好半充满,其离子的电子排布式为________.
(4)氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
已知:H-H键能为436 kJ·mol-1,N≡N键能为945 kJ·mol-1,N-H键能为391 kJ·mol-1.写出合成氨反应的热化学方程式:________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题14物质结构与性质选修3练习卷(解析版) 题型:填空题
图示法和图像法都是常用的科学研究方法。
(1)科学家通过X射线推测胆矾中既含有配位键又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。

①写出基态Cu原子的核外电子排布式________________________________。
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)________。
(2)下图是研究部分元素氢化物的沸点变化规律的图像,折线c可以表达出第________族元素氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是________(填“a”或“b”),理由是______________________________________________________________。

(3)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫做第一电离能(设为E)。如图所示:

①同周期内,随着原子序数的增大,E值变化的总趋势是________;
②根据图中提供的信息,试推断E氧________E氟(填“>”、“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,试推断E镁________E钙。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省乐山市高三“一调”考试理综化学试卷(解析版) 题型:填空题
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物 。
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列 。
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(4)Se原子基态核外电子的排布式为 ;H2Se的沸点:-41.1℃ ,H2S的沸点:-60.4℃,引起两者沸点差异的主要原因是 ;
(5)SO32-离子中硫原子的杂化方式 ,该离子的立体构型为 ;
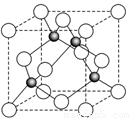
(6)某金属元素A的氧化物用作玻璃、瓷器的颜料、脱硫剂。其立方晶体的晶胞结构如右图所示,
则该氧化物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com