
| A、HNO3 |
| B、NaOH |
| C、NH3 |
| D、Na |


科目:高中化学 来源: 题型:
| A、1mol Cl2与过量的镁铁反应,转移2NA个电子 |
| B、常温下,16g CH4含有8NA个电子 |
| C、1L 0.5mol?L-1 Na2SO4溶液中含有NA个SO42- |
| D、常温常压下,22.4L CO2含有NA个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 原溶液中含有Fe2+和Fe3+ |
| C | 将铜片放入浓硝酸中 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸有强氧化性和酸性 |
| D | 向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 酸性:硅酸>盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
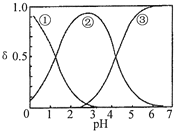 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )| A、曲线①代表的粒子是HC2O4- |
| B、0.1 mol?L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D、一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层电子数为2的原子一定比最外层电子数为3的原子容易失去电子 |
| B、元素的非金属性越强最高价氧化物对应的水化物酸性越强 |
| C、ⅠA族元素都是碱金属元素 |
| D、元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
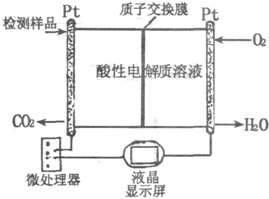 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、铁和稀硝酸反应:Fe+2H+═H2↑+Fe2+ |
| D、碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑+Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com