

(1)写出A、B、C、D各物质的名称:A_____________,B_________________,C_______________,D_______________________。
(2)写出DA的化学反应方程式:_______________________________________________。
(3)写出下列变化的离子方程式:
B![]() C:__________________________________________________________。
C:__________________________________________________________。
D![]() B:__________________________________________________________。
B:__________________________________________________________。
(1)硅 硅酸钠 硅酸(或原硅酸) 二氧化硅
(2)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(3)CO2+H2O+![]()
![]() H2SiO3↓+
H2SiO3↓+![]()
(或2CO2+H2O+![]()
![]() H2SiO3↓+2
H2SiO3↓+2![]() )(产物也可以写成H4SiO4)
)(产物也可以写成H4SiO4)
SiO2+2OH-![]()
![]() +H2O
+H2O
解析:根据图中变化关系可知,D是A的氧化物,单质和其氧化物都能与NaOH溶液反应生成同一产物的可以是Si,即A是Si,B为Na2SiO3,C为H2SiO3(或H4SiO4),D是SiO2。
有关反应的化学方程式为:Si+O2![]() SiO2,
SiO2,
SiO2+2C![]() Si+2CO↑,
Si+2CO↑,
Si+2NaOH+H2O![]() Na2SiO3+2H2↑,
Na2SiO3+2H2↑,
SiO2+2NaOH![]() Na2SiO3+H2O,
Na2SiO3+H2O,
Na2SiO3+CO2+H2O![]() H2SiO3↓+Na2CO3,
H2SiO3↓+Na2CO3,
H2SiO3![]() H2O+SiO2。
H2O+SiO2。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
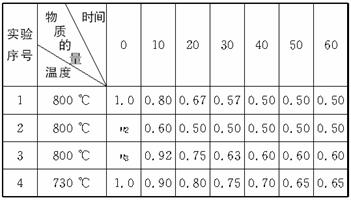
根据上表数据,完成下列填空:
①在实验1中反应在10—20 min内反应的平均速率为 ① mol·(L·min)-1;实验2中采取的措施是 ② ;实验3中n3 ③ 1.0 mol(填“>”“=”或“<”)。
②比较实验4和实验1,可推测该反应中Q ④ 0(填“>”“=”或“<”),理由是 ⑤ 。
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如下图所示,根据图中所示判断下列说法正确的是 ⑥ 。
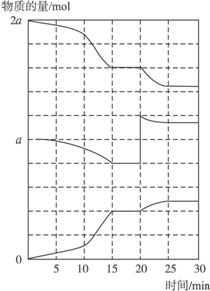
a.10—15 min可能是升高了温度 b.10—15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积 d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5 mol A(g)和3 mol B(g),此时容器的压强为p(始)。反应进行并达到平衡后,测得容器内气体压强为p(始)的![]() 。若相同条件下,向上述容器中分别通入a mol A(g)、b mol B(g)、c mol C(g),欲使达到新平衡时容器内气体压强仍为p(始)的
。若相同条件下,向上述容器中分别通入a mol A(g)、b mol B(g)、c mol C(g),欲使达到新平衡时容器内气体压强仍为p(始)的![]() 。
。
①a、b、c必须满足的关系是 ⑦ , ⑧ 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 ⑨ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
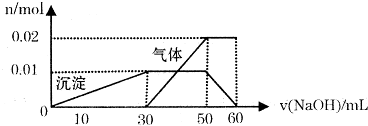
某无色溶液中只可能含有NH4+、K+、Al3+、Fe3+、Cl-、SO42-等离子中的几种离子。
①该溶液的焰色反应呈现出紫色。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。
(1)该溶液中一定含有 (填离子的化学式)离子,一定不含有的离子有 (填离子的化学式);
(2)①根据图中所示数据,计算实验中使用的NaOH溶液的物质的量浓度
为:
②在配制实验所需100mL NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需
要 (填仪器名称)。
(3)根据图示信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为:
查看答案和解析>>
科目:高中化学 来源:2011-2012年河北省高二上学期9月份月考化学(理)试卷 题型:填空题
(每空2分,共18分)在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
|
序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8 0 0 ℃ |
n2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_ 0(填“>、=、<”),理由是_
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示,根据图中所示判断下列说法正确的__ __。
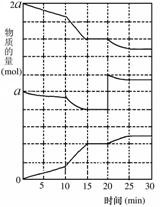
a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。
反应进行并达到平衡后,测得容器内气体压强为P(始)的 。若相同条件下,向上述
容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压
强仍为P(始)的 。
①a、b、c必须满足的关系是 , 。
(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com