
 M和N单质燃烧时均放出大量热,可用作燃料.已知M和N均为短周期元素,其原子的第一至第四电离能如下表所示:
M和N单质燃烧时均放出大量热,可用作燃料.已知M和N均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| M | 932 | 1821 | 15390 | 21771 |
| N | 738 | 1451 | 7733 | 10540 |
 ,MCl2是非极性(填“极性分子”或“非极性分子”);N的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.
,MCl2是非极性(填“极性分子”或“非极性分子”);N的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理. 分析 由表中电离能可知,二者第三电离能都剧增,原子最外层电子数为2,都为短周期元素,同主族自上而下第一电离能降低,故M为Be、N为Mg元素,
Be的原子序数为4,核外电子总数为4,据此写出其原子结构示意图;BeCl2分子中Be形成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型结构,据此判断BeCl2的极性;
根据图示可知,3s能级未填满就填充3p能级,据此进行解答.
解答 解:由表中电离能可知,二者第三电离能都剧增,原子最外层电子数为2,都为短周期元素,同主族自上而下第一电离能降低,故M为Be、N为Mg,
M为Be元素,其原子结构示意图为: ;BeCl2分子中Be形成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型结构,则BeCl2为非极性分子;
;BeCl2分子中Be形成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型结构,则BeCl2为非极性分子;
由电子轨道排布图可知,3s能级未填满就填充3p能级,3s能级能量比3p能级低,所以违背能量最低原理,
故答案为: ;非极性;能量最低原理.
;非极性;能量最低原理.
点评 本题考查核外电子排布,涉及核外电子排布规律、分子极性判断等知识,题目难度中等,注意熟练掌握原子核外电子排布规律,明确极性分子与非极性分子的判断方法.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中 | |
| B. | SiO2可与水反应生成H2SiO3 | |
| C. | 向氯水中加CaCO3粉末,可提高溶液中HClO的浓度 | |
| D. | 向氯水中滴加蓝色石蕊试液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 氢氧燃料电池正极消耗 22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 | |
| D. | 10LpH=13的NaOH溶液中含有的OH-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离溴乙烷和水的混合物 | |
| B. | 用结晶的方法分离氯化钠和硝酸钾的混合物 | |
| C. | 除去含有少量硝酸钡杂质的硝酸钾,可以加入过量的碳酸钾溶液,过滤后除去沉淀,在滤液中加入适量硝酸调至溶液的pH为7 | |
| D. | 除去乙酸乙酯中的少量乙酸,可以加入乙醇和浓硫酸加热,使乙酸全部转化为乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34S原子核内的中子数为16 | B. | 13C和15N原子核内的质子数相差2 | ||
| C. | 16O与18O的核电荷数相等 | D. | 2H+质量与1H+的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )| A. | 催化反应①②均为放热反应 | |
| B. | 催化剂不能改变该反应的反应热 | |
| C. | ClO是该反应的催化剂 | |
| D. | 在该反应过程中没有化学键的断裂与生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
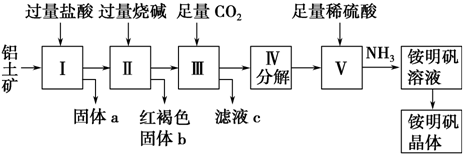
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| M | Y | |
| Z | N |
| A. | 元素Y与元素Z的最高正化合价之和的数值等于13 | |
| B. | 元素Z的含氧酸的酸性比元素N的强 | |
| C. | 离子半径的大小顺序为Z(n+1)->M(n+1)->Yn- | |
| D. | Z的气态氢化物的还原性和热稳定性均比N强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com