
【题目】下列叙述能说明氯元素原子得电子能力比硫元素原子强的是( )
①![]() 的溶解度比
的溶解度比![]() 大 ②
大 ②![]() 的酸性比氢硫酸强 ③
的酸性比氢硫酸强 ③![]() 的稳定性比
的稳定性比![]() 强 ④
强 ④![]() 的还原性比
的还原性比![]() 强 ⑤
强 ⑤![]() 的酸性比
的酸性比![]() 强 ⑥
强 ⑥![]() 与铁反应生成
与铁反应生成![]() ,而
,而![]() 与铁反应生成
与铁反应生成![]() ⑦
⑦![]() 能与
能与![]() 反应生成
反应生成![]() ⑧在元素周期表中
⑧在元素周期表中![]() 处于
处于![]() 同周期的右侧 ⑨还原性:
同周期的右侧 ⑨还原性:![]()
A.③④⑤⑦⑧⑨B.③④⑥⑦⑧
C.③⑥⑦⑧⑨D.①②③④⑤⑥⑦⑧⑨
【答案】C
【解析】
①不能根据氢化物溶解度大小,比较元素原子的得电子能力,①错误;
②不能依据无氧酸酸性强弱,比较元素原子的得电子能力,②错误;
③![]() 的稳定性比
的稳定性比![]() 强,说明
强,说明![]() 元素的非金属性强,得电子能力强,③正确;
元素的非金属性强,得电子能力强,③正确;
④![]() 的还原性比
的还原性比![]() 弱,④错误;
弱,④错误;
⑤比较原子得电子能力的强弱,可比较元素的最高价氧化物对应水化物的酸性强弱,![]() 不是最高价含氧酸,⑤错误;
不是最高价含氧酸,⑤错误;
⑥非金属单质在相同条件下与变价金属反应,产物中变价金属元素的价态越高,说明非金属元素原子得电子能力越强,⑥正确;
⑦![]() 与
与![]() 反应置换出
反应置换出![]() ,说明
,说明![]() 的氧化性强,则
的氧化性强,则![]() 元素的非金属性强,⑦正确;
元素的非金属性强,⑦正确;
⑧同周期元素自左向右,元素的非金属性逐渐增强,⑧正确;
⑨阴离子的还原性越强,对应元素的非金属性越弱,⑨正确。
综合以上分析,③⑥⑦⑧⑨正确。故选C。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】KClO3热分解是实验室制取氧气的一种方法,1molKClO3(s)热分解的能量变化如图所示。实验测得第一放热温度为400℃,第二放热温度为480℃。下列说法正确的是( )
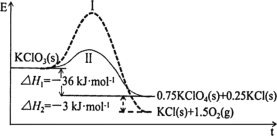
A.400℃时KClO3热分解的产物是KCl和O2
B.若用MnO2作催化剂,KClO3热分解温度大于480℃
C.曲线Ⅰ的活化能大于曲线Ⅱ,所以KClO3比KClO4稳定
D.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
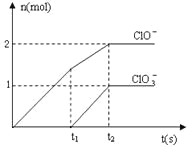
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:_________________________。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后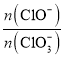 ____2(填“>”、“<”或“=”);
____2(填“>”、“<”或“=”);
若 ,则n(C1-)=_________mol(用含a的代数式来表示)。
,则n(C1-)=_________mol(用含a的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的短周期主族元素,
是原子序数依次增大的短周期主族元素,![]() 核内只有1个质子,
核内只有1个质子,![]() 原子最外层电子数是次外层电子数的3倍,
原子最外层电子数是次外层电子数的3倍,![]() 的二价阳离子与氖原子具有相同的核外电子排布,
的二价阳离子与氖原子具有相同的核外电子排布,![]() 与
与![]() 同主族,下列说法正确的是( )
同主族,下列说法正确的是( )
A.![]() 的原子半径在五种原子中最大
的原子半径在五种原子中最大
B.一定条件下,![]() 的单质能与水反应
的单质能与水反应
C.![]() 与
与![]() 形成的化合物只有一种
形成的化合物只有一种
D.![]() 的最高价氧化物的水化物的酸性比
的最高价氧化物的水化物的酸性比![]() 的弱
的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作回答有关问题:
(1)在盛有![]() 溶液的试管中逐滴滴加少量的
溶液的试管中逐滴滴加少量的![]() 溶液,可观察到的现象是______,该反应的离子方程式为______。
溶液,可观察到的现象是______,该反应的离子方程式为______。
(2)将(1)中所得的混合物平均分成两分,向其中一份中继续滴加![]() 溶液,直至过量,现象是______,反应的离子方程式为______;向另一份中加入足量稀硫酸,现象是______,反应的离子方程式为______。
溶液,直至过量,现象是______,反应的离子方程式为______;向另一份中加入足量稀硫酸,现象是______,反应的离子方程式为______。
(3)(2)中反应说明![]() 所属的物质类别是______。
所属的物质类别是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知( )

A.反应的化学方程式为4X=Y
B.反应进行到t1时,Y的浓度减少了3 mol/L
C.反应进行到t2时,达到平衡状态
D.反应进行到t3时,每生成4 mol Y的同时生成1 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯在食品中作为香料添加剂被广泛使用,其结构简式为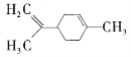 。下列有关柠檬烯的分析正确的是( )
。下列有关柠檬烯的分析正确的是( )
A.1mol柠檬烯完全燃烧消耗14molO2
B.分子中所有碳原子可能在同一平面上
C.和丁基苯(![]() )互为同分异构体
)互为同分异构体
D.一定条件下,可以发生加成反应、取代反应、氧化反应、酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com