
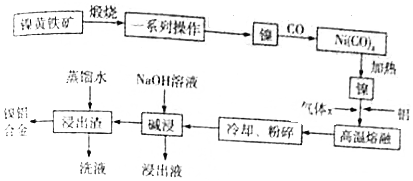
分析 红土镍矿(主要成分为NiS、FeS等)煅烧发生氧化还原反应得到Ni2O3、Fe2O3,经过对铁元素除杂得到镍,再通入CO气体,形成Ni(CO)4,加热得到镍,加入铝,高温熔融时通入惰性气体保护Ni、Al,得到合金,将合金“高温熔融”后冷却、粉碎,再用浓氢氧化钠溶液碱浸,铝与氢氧化钠反应产生氢气使镍铝合金产生多孔的结构,浸出液中含偏铝酸根,最后用蒸馏水洗浸出渣,得到产品镍铝合金,据此分析解答.
解答 解:(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,化合物化合价代数和为0,则Ni化合价为0;
故答案为:0;
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,发生氧化还原反应得到Ni2O3、Fe2O3,其中生成Fe2O3的化学方程式为4FeS+7O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+4SO2;
故答案为:4FeS+7O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+4SO2;
(3)操作“镍$\stackrel{CO}{→}$Ni(CO)4$\stackrel{加热}{→}$镍”的目的是提纯镍;
故答案为:提纯镍;
(4)高温熔融时通入惰性气体保护Ni、Al,防止其被氧化,得到合金;将合金“高温熔融”后冷却、粉碎,再用浓氢氧化钠溶液碱浸,粉碎处理目的是增大接触面积,提高“碱浸“的反应速率;
故答案为:保护Ni、Al,防止其被氧化;增大接触面积,提高“碱浸“的反应速率;
(5)将合金冷却、粉碎,再用浓氢氧化钠溶液碱浸,铝与氢氧化钠反应产生氢气使镍铝合金产生多孔的结构,发生的反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,浸出液中含偏铝酸钠;
故答案为:Na+、AlO2-或[Al(OH)4]-、OH-;
(6)浸出液B中含偏铝酸钠,可通入过量二氧化碳得到氢氧化铝沉淀,再加热灼烧使其分解得到氧化铝,加入冰晶石,在熔融态下电解氧化铝得到铝,回收流程可表示为:浸出液$\stackrel{足量CO_{2}}{→}$Al(OH)3$\stackrel{灼烧}{→}$Al2O3(熔融)$→_{冰晶石}^{电解}$Al;
故答案为:浸出液$\stackrel{足量CO_{2}}{→}$Al(OH)3$\stackrel{灼烧}{→}$Al2O3(熔融)$→_{冰晶石}^{电解}$Al.
点评 本题考查了物质的制备,重点考查学生对工艺流程试题了解掌握情况,试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 0.75 mol/L | C. | 1 mol/L | D. | 0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
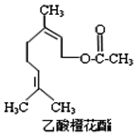 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( ) | A. | ①②③ | B. | ①②⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要配制100mL 0.1mol•L-1 CuSO4溶液.
实验室需要配制100mL 0.1mol•L-1 CuSO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某品牌果冻标签如图所示.回答下列问题:
某品牌果冻标签如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a与氢元素能形成原子个数之比为1:1的化合物 | |
| B. | b单质能与水、无水乙醇反应 | |
| C. | c3+与d-的最外层电子数和电子层数都不相同 | |
| D. | a与d可形成含有极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com